Morphological and genetic features of cisco (coregonidae: coregonus sp.) from lake Sobachye (Putorana plateau)
- Authors: Borovikova E.A.1, Romanov V.I.2, Nikulina J.S.2
-
Affiliations:
- I.D. Papanin Institute for biology of inland water
- National Research Tomsk State University
- Issue: Vol 14, No 3 (2016)
- Pages: 47-55
- Section: Articles
- URL: https://journals.eco-vector.com/ecolgenet/article/view/5482
- DOI: https://doi.org/10.17816/ecogen14347-55
- ID: 5482
Cite item
Full Text
Abstract
Background. Recently was revealed that cisco from Lake Sobachye (Putorana Plateau) is more similar to Coregonus albula Linnaeuas than C. sardinella Valenciennes according to number of vertebrae [13]. The aim of this work was to investigate molecular genetic features of this population.
Materials and methods. For morphological analysis were used 60 specimens of cisco from Lake Sobachye. For nine specimens molecular genetic analysis was performed. The sequences of two fragments of the mitochondrial DNA (ND1 and COI) were defined.
Results. The cisco of the Lake Sobachye significantly differed from riverine cisco of this region by meristic features (namely from cisco of the River Pyasina). Sequencing results showed the minimal divergence of the ND1 and COI sequences of the cisco from Lake Sobachye and vendace.
Conclusion. Morphological analysis and analysis of the mitochondrial DNA polymorphism of cisco from Lake Sobachye revealed close relationship of this population to C. albula.
Full Text
ВВЕДЕНИЕ
Исследования биологии ряпушки бассейна р. Пясины имеют давнюю историю и довольно многочисленны. В литературе приводятся сведения о численности, меристических и пластических признаках, возрастном составе, соотношении полов, сроках нереста и других особенностях ее популяций почти всех крупных водоемов Норило-Пясинской озерно-речной системы: озер Кета, Глубокое, Лама, Арылах, Первое Пуринское и р. Пясины [1–5].
Ряпушка оз. Собачье (бас. р. Пясины) также была охвачена подобными исследованиями. Здесь следует отметить работы О.Л. Ольшанской, которая считала собачинскую ряпушку самой крупной среди ряпушек, населяющих Норильские озера, и относила ее вместе с популяцией озера Глубокое к отдельному подвиду Сoregonus sardinella norilensis Olshanskaya [3, 6]. Ряпушку р. Пясины Ольшанская выделяла в отдельный инфраподвид — С. sardinella infraspecies pjasinae: озерные ряпушки и ряпушка из р. Пясины обнаруживали различия и по пластическим, и по меристическим признакам [3, 4].
Интересным представляется такой факт: большинство ихтиологов a priori полагают, что если ряпушка обитает в азиатской части Субарктики, то она обязательно относится к виду Сoregonus sardinella Valenciennes — сибирская ряпушка. Действительно, традиционно считается, что ареал сибирской ряпушки приурочен к водоемам Сибири и с ареалом еще одного евразийского вида — европейской ряпушки C. albula (Linnaeus) — перекрывается лишь в районе р. Печора [7]. Вероятно, поэтому ни в одной из работ, посвященных ряпушке Норильских озер, не проводился анализ числа позвонков — основного признака, используемого для видовой идентификации сибирской и европейской ряпушек.
В то же время, несмотря на довольно четкую приуроченность европейской и сибирской ряпушек к определенным географическим регионам, был период, когда статус их как отдельных видов подвергался сомнению. Поводом для дискуссий послужило отсутствие хиатуса между ними по диагностическим морфологическим признакам [8–10]. Так, даже в случае такого «хорошего» видоспецифического признака, как число позвонков, четкая дифференциация между C. albula и C. sardinella отсутствует: к первому виду относятся ряпушки с 54–59 (чаще 55–56) позвонками, а ко второму — с 57–64 (часто в среднем имеют более 60 позвонков) [7]. Кроме того, как правило, данный критерий удовлетворительно показывает принадлежность конкретной популяции ряпушки к тому или иному виду лишь по результатам анализа статистически достоверных выборок на основе оценки средних величин.
Согласно данным молекулярно-генетических исследований носители распространенных в европейских водоемах гаплотипов митохондриальной ДНК (мтДНК) обнаружены далеко за пределами ареала европейской ряпушки (западная часть п-ва Ямал). С другой стороны, аллели локуса креатинфосфокиназы, типичные для сибирских популяций, так же как и «сибирские» гаплотипы мтДНК, обнаружены в водоемах европейской территории России [11, 12].
Наши исследования популяции ряпушки оз. Собачье дополняют материалы ранее опубликованных работ: в частности, проанализирован половой диморфизм собачинской ряпушки, восполнен пробел, касающийся числа позвонков [13]. Поскольку ряпушка оз. Собачье согласно проведенному морфологическому анализу по диагностическим признакам (малое число позвонков, некоторые пластические признаки) оказалась ближе европейской ряпушке [13], основной целью настоящей работы стало изучить особенности ее генетического полиморфизма и филогеографии, прояснить вопросы филогенетических взаимоотношений с сибирской и европейской ряпушками, сопоставить результаты видового диагноза на основе анализа морфологических признаков, с одной стороны, и генетических особенностей — с другой.
МАТЕРИАЛ И МЕТОДЫ
Сбор материала ряпушки оз. Собачье осуществлялся в 2014 г. с 17 июля по 20 августа в районе кордона заповедника «Путоранский». Объем выборки составил 60 особей. Исследование морфологических признаков проведено согласно методическим рекомендациям работы [14]. При статистической обработке данных использовалось руководство Г.Ф. Лакина [15].
Для анализа полиморфизма фрагментов мтДНК использовали пробы ткани (белая мышца, жировой плавник), фиксированные 96 % этанолом (1 : 5). Тотальную клеточную ДНК выделяли с использованием наборов реагентов DIAtomTMDNAPrep100 (ООО «Лаборатория Изоген») или ДНК–Экстран-2 (ЗАО «Синтол»). Объем выборки составлял 27 особей; в дальнейшем, однако, не все экземпляры были взяты в анализ ввиду низкого качества выделенной ДНК.
Первоначально с полученных образцов клеточной ДНК синтезировали так называемый ND1-фрагмент мтДНК длиной примерно 2050 пар нуклеотидов (п. н.), включающий ген субъединицы I NADH-дегидрогеназного комплекса. Синтез фрагмента (амплификацию) проводили с применением праймеров LGL381 и LGL563 [16, 17] в 25 мкл буфера для амплификации (НПО «СибЭнзим»). Смесь содержала также 100–300 нг ДНК; по 0,4 пмоль каждого из двух праймеров; по 200 нмоль каждого из четырех дезоксирибонуклеотидов и 0,5–1 единиц активности (ед. а.) Taq-ДНК полимеразы. Сверху для предотвращения испарения в ходе ПЦР на смесь наслаивали минеральное масло. Программа амплификации ND1-фрагмента включала этап первоначальной денатурации ДНК: +95 °C — 5 мин; 32 цикла синтеза фрагмента: +95 °C — 1 мин, + 53 °C — 50 с, + 72 °C — 1 мин 15 с; заключительный этап достройки концов: + 72 °C — 5 мин.
Поскольку возможности определить последовательность нуклеотидов для всех образцов выборки не было, первоначально полученный ND1-фрагмент обрабатывали эндонуклеазой рестрикции RsaI с целью выявления носителей гаплотипов Е и S, которые маркируют разные филогенетические линии ряпушки. Первый гаплотип широко распространен в европейских водоемах; встречается он и в Сибири, хотя и значительно реже. Второй вариант типичен для восточносибирских популяций ряпушки (бас. рек Колыма, Индигирка) [11, 17].
Реакцию рестрикции с RsaI проводили в 10 мкл буфера, рекомендованного фирмой-производителем (ThermoScientific). Смесь содержала 3 мкл ПЦР-продукта ND1-фрагмента и 0,5 ед. а. фермента. Длины рестриктных фрагментов после расщепления ПЦР-продукта анализировали в 1,7 % агарозном геле; для электрофореза использовали трис-ЭДТА-боратную буферную систему [18].
На основе результатов скрининга с RsaI отбирали пробы для дальнейшего секвенирования: в анализ были взяты особи с гаплотипом Е, лишь одна особь характеризовалась вариантом S. В общей сложности определение нуклеотидной последовательности проводилось для девяти экземпляров ряпушки, причем для пяти из них определены последовательности двух фрагментов мтДНК: ND1 и участка гена первой субъединицы цитохром с-оксидазы (COI).
Состав и объем амплификационной смеси при подготовке образцов для секвенирования обеих участков мтДНК был одинаковым за исключением количества праймеров. ПЦР проводилась в 20 мкл буфера для амплификации (концентрация MgCl2 15–20 мМ) (НПО «СибЭнзим»); смесь содержала 100–300 нг тотальной клеточной ДНК; по 200 нмоль каждого из четырех дезоксирибонуклеотидов; 0,5–1 ед. а. Taq-ДНК полимеразы. Сверху для предотвращения испарения в ходе ПЦР на смесь наслаивали минеральное масло.
Для определения нуклеотидной последовательности ND1-фрагмента он был разделен на четыре перекрывающихся участка длиной примерно по 500 п. н. каждый. При постановке ПЦР использовали четыре пары праймеров согласно работе [19], реакционная смесь содержала по 0,5 пмоль каждого праймера. Программа амплификации состояла из следующих этапов: первоначальная денатурация ДНК: + 94 °C — 2 мин; 32 цикла синтеза фрагмента: + 94 °C — 30 с, + 52 °C — 30 с, + 72 °C — 50 с; заключительный этап достройки концов: + 72 °C — 5 мин [19, с модификацией].
Синтез фрагмента гена первой субъединицы цитохром с-оксидазы, проводили с использованием праймеров Fish-F1 и Fish-R1 [20]. Количество праймеров в реакционной смеси объемом 20 мкл было равно 0,25 пмоль каждого. Программа амплификации включала этапы: денатурацию ДНК при + 95 °C — 1 мин; 32 цикла синтеза фрагмента: + 95 °C — 1 мин, + 54 °C — 40 с и + 72 °C — 40 с; заключительная достройка концов фрагмента: + 72 °C — 10 мин [20, с модификацией].
Секвенирование проводили на автоматическом анализаторе 3500 ABI (8 капилляров) согласно рекомендациям производителя на базе ИБВВ РАН. Протяженность ND1-фрагмента, нуклеотидная последовательность для которого была определена, варьировала у разных образцов от 1749 до 1970 п. н.; длина секвенированного участка COI составила около 600–650 п. н. Все последовательности депонированы в базу данных GenBank (NCBI) под номерами KU760906, KU760907, KU760909–KU760914.
Чтение и анализ полиморфизма нуклеотидных последовательностей проводили в программах MEGA6 [21] и DnaSP v.5 [22]. Для построения медианных сетей гаплотипов использовали программу Network 5.0.0.0 [23]. Поиск сайтов рестрикции RsaI в последовательностях ND1-фрагмента ряпушки р. Курейка (бас. р. Енисей; номера NCBI JN629025–JN629029) осуществляли с использованием онлайн-программы [24, 10.04.2016]. В ходе анализа полученных данных, кроме описанных нами гаплотипов ряпушки оз. Собачье, использованы последовательности из NCBI: C. albula водоемы Польши (DQ399869, KT426542–KT426556), водоемы Германии (DQ399870, KM286532, КМ286534, KM286535, KM286537, КМ286539, KM286540–KM286542, КМ286544, KM286545, KM286548, KM286552–КМ286554, КМ286556, KM286559–KM286561, КМ286563, КМ286566, КМ286568–KM286570, КМ286573, КМ286574, KM286576, КМ286578, KM286581, КМ286583, KM286585, KM286588, KM286590, КМ286591, КМ286605, KM286611, KM286613, КМ286616), озера Швеции (KJ128463, KJ128464), озера европейской части России (JX960877, KT254047, KT254048, KT254057); C. fontanae (KM286597); C. lucinensis (KM286607); C. sardinella водоемы Северной Америки (EU202653, EU523982, EU523983, EU523985, EU523986), водоемы Сибири (JN629025–JN629029, KT267305). Видовые названия приводятся согласно аннотации в NCBI.
РЕЗУЛЬТАТЫ
Особенности морфологии ряпушки оз. Собачье. Из всех других популяций Норило-Пясинской системы собачинская ряпушка, наряду с ряпушкой озера Кета, наиболее изолирована от полупроходной пясинской ряпушки: в период осенней преднерестовой миграции пясинская ряпушка проходит на нерестилища, расположенные в крупных притоках и в самой реке, вплоть до р. Рыбной, которая в районе водопада Китабо-Орон становится для нее непроходимой. Поэтому нами предпринято сравнение меристических признаков ряпушек оз. Собачье и р. Пясины; в случае пясинской ряпушки использованы данные О.Л. Ольшанской [3] (табл. 1).

Проведенный анализ выявил достоверные различия между сравниваемыми популяциями по пяти признакам из семи. У собачинской ряпушки оказалось достоверно меньшим число чешуи в боковой линии и число ветвистых лучей в спинном и анальном плавниках: в среднем она имеет здесь примерно на один луч меньше. Данные показатели могут быть использованы для диагноза сибирской и европейской ряпушек, так как число ветвистых лучей в этих плавниках у ряпушек Сибири в среднем почти на один луч превышает соответствующий показатель для популяций европейского вида [25].
Поскольку в работе О.Л. Ольшанской [3] данные о числе позвонков ряпушки р. Пясина не приводятся, для сравнения использованы собственные данные, полученные в ходе анализа выборки из Пясинского залива [26]. Как и в случае числа лучей в плавниках, собачинская ряпушка характеризуется достоверно меньшим числом позвонков: по средним величинам этого показателя рассматриваемые популяции ряпушки отличаются друг от друга более чем на пять позвонков, что значительно превышает уровень подвидового различия (CD) по Э. Майеру (см. табл. 1). Кроме того, пясинская ряпушка имеет достоверно меньшее число жаберных тычинок; согласно нашим данным, среднее число жаберных тычинок ряпушки Пясинского залива составило 47,13 [26], что выше значений этого признака, приводимых О.Л. Ольшанской [3].
Особенности полиморфизма фрагментов митохондриальной ДНК ряпушки оз. Собачье. Девять проанализированных последовательностей COI ряпушки оз. Собачье оказались отнесены к пяти гаплотипам — С1, Sob6, Sob96, Sob97, Sob99, первый из которых характерен для ряпушек из водоемов Европы, Сибири и Северной Америки (рис. 1). Следует отметить, что гаплотип С1 у ряпушки озера Собачье является наиболее частым: носителями его оказались четыре (44,4 %) из девяти взятых в анализ особей. Остальные четыре уникальных, отмеченных только в данной популяции, гаплотипа отличались от варианта С1 одной-двумя нуклеотидными заменами (р-дистанция 0,2–0,3 %). В целом дифференциация гаплотипов COI ряпушки оз. Собачье невелика: значения р-дистанции варьируют от 0,0 до 0,5 %, в среднем — 0,2 %. Основные показатели внутрипопуляционного полиморфизма данного фрагмента мтДНК приведены в таблице 2.
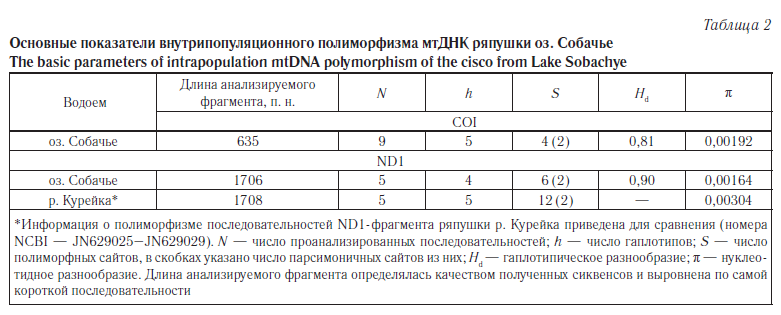
Кроме полиморфизма внутри исследуемой популяции оценивали уровень дивергенции ее с ряпушкой других водоемов. Оказалось, что даже наибольшие различия между последовательностями COI оз. Собачье и последовательностями, взятыми в анализ из NCBI, не превышают максимальной дифференциации вариантов COI ряпушки водоемов Европы. Так, максимальное число различий между гаплотипами COI европейской ряпушки достигает 13 синонимичных нуклеотидных замен (варианты С3 и С8; p-дистанция 2,6 %). Число замен между гаплотипом ряпушки оз. Собачье Sob6 и вариантом С8 равно 11 (p-дистанция 2,2 %), причем все замены, как и в первом случае, синонимичны. Депонированных последовательностей COI сибирской ряпушки в базе данных NCBI значительно меньше, чем европейской; большая часть из них соответствует распространенному гаплотипу С1 (см. рис. 1).
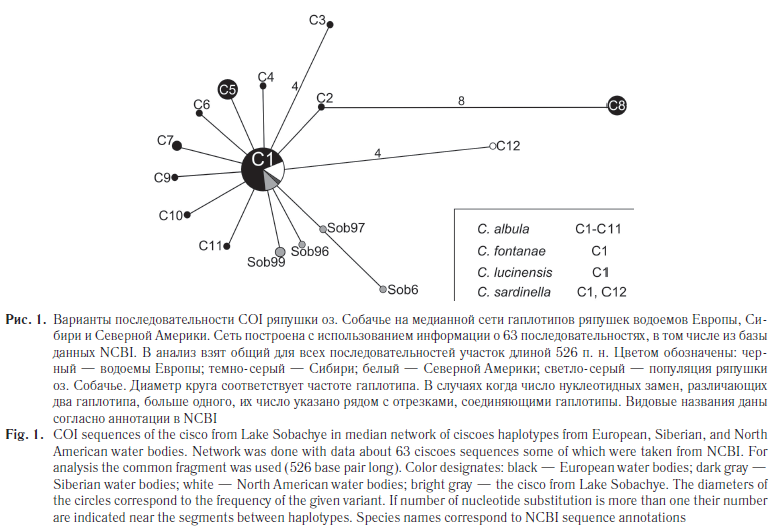
Для ND1-фрагмента ряпушки оз. Собачье описано четыре гаплотипа (Sob2, Sob3, Sob93, Sob97), один из которых (Sob93) был выявлен у двух особей из пяти, взятых в анализ. Гаплотипы ND1 исследованной популяции ряпушки образуют отдельную ветвь медианной сети (рис. 2). Следует отметить, что все пять особей, последовательность ND1-фрагмента для которых была определена, явились носителями гаплотипа Е по сайтам RsaI.

В целом же среди особей, взятых в анализ первоначально, лишь у одной был выявлен «сибирский» гаплотип S. К сожалению, получить качественный сиквенс ND1-фрагмента этого экземпляра не удалось. Интересно, что согласно результатам анализа последовательности COI для этой особи характерен уникальный гаплотип Sob96, отличающийся от распространенного в популяции С1 варианта одной несинонимичной нуклеотидной заменой (см. рис. 1).
p-Дистанция между наиболее частым гаплотипом N1, характерным для ряпушки европейских водоемов, и вариантами ND1-фрагмента ряпушки оз. Собачье варьировала от 1,1 до 5,6 % (среднее значение 4,5 %). С гаплотипами же сибирской ряпушки из р. Курейка (N8–N11) различия последовательностей собачинской ряпушки оказались значительнее — от трех до десяти пар нуклеотидов (p-дистанция 3,4–11,2 %, в среднем — 5,8 %). При этом значения р-дистанции между гаплотипами ND1 внутри популяции рассматриваемого озера изменялись от 1,1 до 5,6 %; средняя оценка этого показателя равна 3,0 %.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ внутри- и межпопуляционного полиморфизма последовательностей ND1- и COI-фрагментов мтДНК свидетельствует о филогенетической близости собачинской ряпушки ряпушке европейских водоемов. Так, в случае фрагмента COI, который используется для идентификации видов в рамках программы «Штрихкодирование жизни» (Barcode of Life), ряпушку оз. Собачье и водоемов Европы сближает наличие общего гаплотипа C1 (см. рис. 1). Средние значения показателя дифференциации (р-дистанции) второго анализируемого участка, ND1-фрагмента, оказались меньше между последовательностями собачинской ряпушки и гаплотипами ряпушки водоемов Европы (озера Польши), чем гаплотипами ряпушки р. Курейка (бас. р. Енисей): 4,5 и 5,8 % соответственно.
Интересно, что рассчитанные с использованием информации базы данных NCBI средние показатели внутривидовой дифференциации для C. albula составили для COI 0,5 и 1,2 % для ND1-фрагмента; в случае C. sardinella — 0,2 и 0,6 % соответственно. Уровень дивергенции между C. albula и C. sardinella равен для COI — 0,4 %; для ND1 — 1,0 %. В то же время оценки дифференциации между европейской ряпушкой и такими «хорошими» видами, как сиг C. lavaretus (Linnaeus), арктический омуль C. autumnalis (Pallas), чир C. nasus (Pallas) и другие в среднем составили для COI около 2,0 %, а для ND1 — 4,0 %.
Приведенные данные позволяют высказать ряд предположений относительно происхождения популяции ряпушки оз. Собачье: вероятно, бóльшая часть ее происходит от филогенетической линии европейских ряпушек. Возможность расселения ряпушки из водоемов Европы на восток в период по крайней мере последнего оледенения обсуждается в работах [11, 27].
В то же время проникали в водоем и представители других (одной или нескольких) филогенетических линий. Так, поскольку согласно результатам ПЦР-ПДРФ-анализа ND1-фрагмента с рестриктазой RsaI в оз. Собачье была обнаружена особь — носитель гаплотипа S, можно предполагать существование потока вселенцев с востока Сибири (бас. рек Колыма и Индигирка), где этот гаплотип встречается чаще всего [17]. При продвижении на запад частота гаплотипа S в популяциях ряпушки снижается [11]. Следует отметить, что по результатам виртуального анализа полиморфизма ND1-фрагмента по сайтам RsaI для ряпушки р. Курейка также оказался характерен гаплотип Е.
Обособленность отдельной ветви гаплотипов ND1-фрагмента собачинской ряпушки на медианной сети может быть связана с формированием специфичного внутрипопуляционного полиморфизма в условиях изоляции. Многие популяции ряпушки Европы также характеризуются наличием типичных только для них уникальных гаплотипов на фоне одного-двух широко распространенных [11].
С частичной или полной изоляцией собачинской популяции может быть связан и низкий уровень внутрипопуляционного полиморфизма последовательностей ND1-фрагмента по сравнению с ряпушкой р. Курейка (см. табл. 2). Небольшие по численности изолированные популяции оказываются более чувствительными к действию случайных генетико-автоматических процессов (дрейф генов) [28].
В то же время, согласно результатам анализа полиморфизма участка гена COI, приведенные выше рассуждения о причинах формирования особенностей генетической структуры популяции ряпушки оз. Собачье могут показаться не совсем верными. Так, принимая во внимание полиморфизм COI, популяции ряпушки разных водоемов, удаленных друг от друга географически, с разной экологией, филогенетически кажутся ближе друг другу, чем если рассматривать результаты анализа полиморфизма ND1-фрагмента. Действительно, один и тот же вариант последовательности COI (C1) оказался типичен как для европейских озерных популяций ряпушки, так и для полупроходной ряпушки Сибири (море Лаптевых, Тикси); этот же вариант распространен и у C. sardinella озер Северной Америки.
Объяснением указанных выше фактов, как и различий в структуре сетей гаплотипов COI и ND1, может быть разная скорость накопления мутаций в последовательностях разных маркерных фрагментов. Так, анализ результатов секвенирования митохондриального генома сиговых показал, что наибольшая скорость эволюции характерна для генов НАДН-дегидрогеназного комплекса (ND), цитохрома б (cyt b) и контрольной области. Гены цитохром оксидазы (COX) и тРНК имеют скорость эволюции в 2–3 раза меньше, чем ND-гены; еще медленнее накапливают замены рибосомальные гены и гены АТФ [29].
Полученные с использованием молекулярно-генетических методов анализа результаты согласуются с данными об особенностях морфологии ряпушки рассматриваемого водоема: меньшее число позвонков собачинской ряпушки сближает ее с ряпушкой Европы [13]. Отметим, что ранее популяции относительно малопозвонковых ряпушек были отмечены и в других водоемах Таймыра [26, 30]. В то же время в бассейне р. Пясины присутствует и полупроходная форма с бóльшим числом позвонков, что характерно для типичной сибирской ряпушки [13].
Таким образом, согласно результатам анализа полиморфизма мтДНК ряпушка оз. Собачье более близка в своем происхождении филогенетической линии европейской ряпушки. Вместе с тем на особенности генетического разнообразия ее популяции оказали влияние такие факторы, как контакт с представителями восточносибирской филогенетической линии ряпушки и длительное существование в условиях частичной или полной изоляции.
Благодарности. Авторы благодарят сотрудников Объединенной дирекции заповедников Таймыра за предоставленную возможность проведения исследований на территориях заповедников «Путоранский» и «Большой Арктический» и помощь в сборе материала; Л.А. Глущенко, сотрудницу ФГАОУ ВПО «Сибирский федеральный университет» — за помощь в сборе образцов ряпушки оз. Собачье для последующего генетического анализа. Работа проведена при финансовой поддержке гранта РНФ № 16-14-10001.
Конфликт интересов: не заявлен.
About the authors
Elena A. Borovikova
I.D. Papanin Institute for biology of inland water
Author for correspondence.
Email: elena.ibiw@gmail.com
researcher, Laboratory of Fish Ecology Russian Federation
Vladimir I. Romanov
National Research Tomsk State University
Email: icht.nrtsu@yandex.ru
ScD, professor Head of Department. Department of the Ichthyology and Hydrobiology Russian Federation
Julia S. Nikulina
National Research Tomsk State University
Email: JuliaNikulina0506@gmail.com
assistant. Department of the Ichthyology and Hydrobiology Russian Federation
References
- Остроумов Н.А. Рыбы и рыбный промысел р. Пясины // Труды Полярной комиссии. — 1937. — Вып. 30. — С. 3–115. [Ostroumov NA. Ryby i rybnyy promysel r. Pyasiny. Trudy Polyarnoy komissii. 1937; (30):3-115. (In Russ).]
- Ольшанская О.Л. Ряпушка бассейна реки Пясины // Труды Сибирского отделения ГосНИОРХ. — 1964. — Т. 8. — С. 157–159. [Ol’shanskaya OL. Ryapushka basseyna reki Pyasiny. Trudy Sibirskogo otdeleniya GosNIORKh. 1964;8:157-159. (In Russ).]
- Ольшанская О.Л. Ряпушка системы реки Пясины // Труды Красноярского отделения СибНИИРХ. — 1967. — Т. 9. — С. 94–213. [Ol’shanskaya OL. Ryapushka sistemy reki Pyasiny. Trudy Krasnoyarskogo otdeleniya SibNIIRKh. 1967; 9:94-213. (In Russ).]
- Максимов С.В., Савваитова К.А., Пичугин М.Ю. Сибирская ряпушка Coregonus sardinella из водоемов Норило-Пясинской водной системы // Вопросы ихтиологии. — 1995. — Т. 35. — Вып. 4. — С. 445–454. [Maksimov SV, Savvaitova KA, Pichugin MYu. Sibirskaya ryapushka Coregonus sardinella iz vodoemov Norilo-Pyasinskoy vodnoy sistemy. Voprosy ikhtiologii. 1995; 35(4):445-454. (In Russ).]
- Павлов Д.С., Савваитова К.А., Груздева М.А., и др. Разнообразие рыб Таймыра. — М.: Наука, 1999. — 207 c. [Pavlov DS, Savvaitova KA, Gruzdeva MA, et al. The diversity of fishes from Taimyr Peninsula. Moscow: Nauka; 1999. 207 p. (In Russ).]
- Ольшанская О.Л. Обзор ихтиофауны бассейна реки Пясины // Вопросы ихтиологии. — 1965. — Т. 5. — Вып. 2. — С. 262–278. [Ol’shanskaya OL. Obzor ikhtiofauny basseyna reki Pyasiny. Voprosy ikhtiologii. 1965;5(2):262-278. (In Russ).]
- Решетников Ю.С., Попова О.А., Соколов Л.И., и др. Атлас пресноводных рыб России. В 2 т. Т. 1. / Под ред. Ю.С. Решетникова. — М.: Наука, 2002. — 379 с. [Reshetnikov YuS, Popova OA, Sokolov LI, et al. Atlas of Russian freshwater fishes. In Two Volumes. Vol. 1. YuS. Reshetnikov, editor. Moscow: Nauka; 2002. 379 p. (In Russ).]
- Дрягин П.А., Пирожников П.Л., Покровский В.В. Полиморфизм сиговых рыб (Coregoninae) и его биологическое и рыбохозяйственное значение // Вопросы ихтиологии. — 1969. — Т. 9. — Вып. 1. — С. 14–25. [Dryagin PA, Pirozhnikov PL, Pokrovskiy VV. Polimorfizm sigovykh ryb (Coregoninae) i ego biologicheskoe i rybokhozyaystvennoe znachenie. Voprosy ikhtiologii. 1969;9(1):14-25. (In Russ).]
- Пирожников П.Л., Дрягин П.А., Покровский В.В. О таксономическом ранге и филогении сиговых (Coregonidae, Pisces) // Известия ГосНИОРХ. — 1975. — Т. 104. — С. 5–17. [Pirozhnikov PL, Dryagin PA, Pokrovskiy VV. O taksonomicheskom range i filogenii sigovykh (Coregonidae, Pisces). Izvestiya GosNIORKh. 1975;104:5-17. (In Russ).]
- Решетников Ю.С. Экология и систематика сиговых рыб. — М.: Наука, 1980. — 300 с. [Reshetnikov YuS. Ekologiya i sistematika sigovykh ryb. Moscow: Nauka; 1980. 300 p. (In Russ).]
- Боровикова Е.А. Филогеография ряпушек Coregonus albula (L.) и C. sardinella Valenciennes Европейского Севера России: Автореф. дис. … канд. биол. наук. М.: 11-й формат, 2009. — 24 с. [Borovikova EA. Phylogeography of the ciscoes Coregonus albula (L.) and C. sardinella Valenciennes in European North of Russia. [dissertation]. Moscow: 11th Format; 2009. 24 p. (In Russian with English abstract).]
- Боровикова Е.А., Махров А.А. Обнаружение гаплотипа митохондриальной ДНК, характерного для сибирской ряпушки Coregonus sardinella (Valenciennes, 1848), в популяции европейской ряпушки C. albula (Linnaeus, 1758) Водлозера (бассейн Балтийского моря) // Известия РАН. Серия биологическая. — 2009. — № 1. — С. 95–99. [Borovikova EA, Makhrov AA. Detection of the mitochondrial DNA haplotype characteristic of the least cisco (Coregonus sardinella, Valenciennes, 1848) in the vendace (C. albula, Linnaeus, 1758) population of Vodlozero (the Baltic Sea Basin). Biology Bulletin. 2009;36(1):80-83]. doi: 10.1134/S1062359009010129.
- Романов В.И., Заделёнов В.А., Никулина Ю.С., Поляева К.В. Морфология и паразитология ряпушки озера Собачьего (плато Путорана) // Вестник НГАУ. — 2016. — Т. 38. — № 1. — С. 69–77. [Romanov VI, Zadelenov VA, Nikulina YuS, Polyaeva KV. Morphology and parasitology of the Sobachye Lake Coregonus albula L. (Plateau Putorana). Bulletin of the Novosibirsk State Agrarian University. 2016;38(1):69-77. (In Russian with English abstract).]
- Правдин И.Ф. Руководство по изучению рыб. — М.: Пищевая промышленность, 1966. — 376 с. [Pravdin IF. Rukovodstvo po izucheniyu ryb. Moscow: Pishchevaya promyshlennost’; 1966. 376 p. (In Russ).]
- Лакин Г.Ф. Биометрия: Учебное пособие для биологических специальностей вузов. — М.: Высшая школа, 1980. — 293 с. [Lakin GF. Biometriya: Uchebnoe posobie dlya biologicheskikh spetsial’nostey vuzov. Moscow: Vysshaya shkola; 1980. 293 p. (In Russ).]
- Cronin MA, Spearman WJ, Wilmot RL, et al. Mitochondrial DNA variation in chinook (Oncorhynchus tshawytscha) and chum salmon (O. keta) detected by restriction enzyme analysis of polymerase chain reaction (PCR) products. Can J Fish Aquat Sci. 1993;50:708-715. doi: 10.1139/f93–081.
- Politov DV, Gordon NYu, Afanasiev KI, et al. Identification of palearctic coregonid fish species using
- mtDNA and allozyme genetic markers. J Fish Biol. 2000;
- (Suppl.A):51-71. doi: 10.1111/j.1095–8649.2000.tb02244.x.
- Green MR, Sambrook J. Molecular cloning:A laboratory manual. In Three Volumes. Vol. 1. New York: Cold Spring Harbor Laboratory Press; 2012. 628 p.
- Bochkarev NA, Zuykova EI, Katokhin AV. Morphology and mitochondrial DNA variation of the Siberian whitefish Coregonus lavaretus pidschian (Gmelin) in the upstream water bodies of the Ob and Yenisei Rivers. Evol Ecol. 2011;25(3):557-572. doi: 10.1007/s10682–010–9437–7.
- Ward RD, Zemlak TS, Innes BH, et al. DNA barcoding Australia’s fish species. Philos Trans R Soc Lond. B Biol Sci. 2005;360(1462):1847-1857. doi: 10.1098/rstb.2005.1716.
- Tamura K, Stecher G, Peterson D, Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0. Mol. Biol. Evol. 2013;30:2725-2729. doi: 10.1093/molbev/mst197.
- Librado P, Rozas J. DnaSP v5:A software for comprehensive analysis of DNA polymorphism data. Bioinformatics. 2009;25(11):1451-1452. doi: 10.1093/bioinformatics/btp187.
- Bandelt H-J, Forster P, Röhl A. Median-joining networks for inferring intraspecific phylogenies. Mol Biol Evol. 1999;16(1):37-48.
- Restriction Mapper version 3. Cited 10.04.2016. URL:http://restrictionmapper.org/index.html/.
- Коновалов А.Ф., Болотова Н.Л. Морфологические особенности гибридных популяций ряпушки в водоемах на водоразделе Белого, Каспийского и Балтийского морей // Вестник АГТУ. Серия «Рыбное хозяйство». — 2014. — № 1. — С. 7–17. [Konovalov AF, Bolotova NL. Morphological peculiarities of hybrid populations of vendace in the reservoirs of watershed White, Caspian and Baltic Seas. Bulletin of Astrakhan State Technical University. Series: Fishing Industry. 2014;1:7-17. (In Russian with English abstract).]
- Романов В.И. Ихтиофауна плато Путорана / Фауна позвоночных животных плато Путорана. Общ. ред. А.А. Романов. — М.: Наука, 2004. — С. 29–89. [Romanov VI. Piscifauna of the Putorana Plateau. In: AA. Romanov, editor. Vertebrate fauna of the Putorana Plateau. Moscow: Nauka; 2004:29-89. (In Russian with English abstract).]
- Borovikova EA, Alekseeva YaI, Schreider MJ, et al. Morphology and genetics of the ciscoes (Actinopterygii: Salmoniformes: Salmonidae: Coregoninae: Coregonus) from the Solovetsky Archipelago (White Sea) as a key to determination of the taxonomic position of the ciscoes in Northeastern Europe. Acta Ichtyol Pisc. 2013;43(3):183-194. doi: 10.3750/AIP2013.43.3.02.
- Алтухов Ю.П. Генетические процессы в популяциях. — М.: ИКЦ Академкнига, 2003. — 431 с. [Altukhov YuP. Intraspecific Genetic Diversity. Monitoring, conservation and management. Berlin, Heidelberg: Springer-Verlag, 2006. 438 p. doi:10.1007/
- –540–30963–2].
- Jacobsen MW, da Fonseca RR, Bernatchez L, Hansen MM. Comparative analysis of complete mitochondrial genomes suggests that relaxed purifying selection is driving high nonsynonymous evolutionary rate of the NADH2 gene in whitefish (Coregonus ssp.). Mol Phylogenet Evol. 2016;95:161-170. doi: 10.1016/j.ympev.2015.11.008.
- Романов В.И. Морфо-экологическая характеристика ряпушки из озера Томмот (бассейн р. Хатанги) и некоторые дискуссионные вопросы систематики евразийских ряпушек // Сибирский экологический журнал. — 2000. — № 3. — С. 293–304. [Romanov VI. Morphoecological characteristics of Coregonus from the Lake Tommot (River Khatanga basin) and some disputable questions of European Coregonus systematics. Sibirskiy Ekologicheskiy Zhurnal. 2000;(3):293-304. (In Russian with English abstract).]
Supplementary files













