The genetic structure of populations of specially protected mollusk Cepaea vindobonensis (Mollusca, Gastropoda, Pulmonata) in a north-eastern part of the modern area
- Authors: Snegin E.A.1, Snegina E.A1
-
Affiliations:
- Belgorod national research university
- Issue: Vol 14, No 3 (2016)
- Pages: 13-27
- Section: Articles
- URL: https://journals.eco-vector.com/ecolgenet/article/view/5479
- DOI: https://doi.org/10.17816/ecogen14313-27
- ID: 5479
Cite item
Full Text
Abstract
Background. The population structure of relict and protected species Cepaea vindobonensis Fer. (Mollusca, Gastropoda, Pulmonata) in a north-eastern part of the modern area has been studied. State population gene pools (11 populations) for environmental activities need to be assessed.
Materials and Methods. Using allozymes (esterases) and DNA markers (RAPD, ISSR) analysis was performed. The methods polyacrylamide gel electrophoresis and the DNA in the agarose gel were used.
Results. The populations with a low level of heterozygosity and high heterozygosity were identified. Group located in the east, did not differ in allelic diversity of the western groups. The average expected heterozygosity for allozyme He = 0,217 ± 0,080 and DNA markers He = 0,164 ± 0,024. However, the population of the Austrian snail in the study area is strongly separated from each other (Fst = 0,231, Gst = 0,265, Фst = 0,261-0,263, Nm = 0,630-0,832). The effective population size (Ne), calculated on the basis of the inbreeding coefficient, was level 0,868 ± 0,028 of the total population. The effective population size, calculated on the basis of the linear regression equation between genetic and geographic distance (Ne = 0,36-2,6) and calculated by a factor of subdivision of populations (Ne = 6,3 ± 0,1), in comparison with the effective size of the populations of common species of terrestrial mollusks was the same.
Conclusion. Thus, on the basis of these data, in general, we can say, the Austrian population snails have a higher potential for life. However, the reduction of allelic diversity, the increase in the coefficient of inbreeding in some groups and a high level of isolation of populations of C. vindobonensis in the north-eastern part of the range is a concern and requires an adjustment in respect of environmental protection measures of this species.
Full Text
Введение
Одной из важных сторон работы по сохранению среды жизни стало создание и ведение Красных книг растений и животных. Причем в последние десятилетия такая работа все больше проводится с упором на региональные системы мониторинга, так как особенности урбанизации и возникающие при этом экологические проблемы специфичны для различных ландшафтов. Известно, что исчезновение любого вида начинается с исчезновения его популяций, в результате значительно сокращается ареал, уменьшается генетическое разнообразие и, как следствие, происходит потеря устойчивости и вымирание. При этом первыми, как правило, страдают группы, расположенные на краях видовых ареалов или на каких-то изолированных территориях, так как при расселении, в силу генетического дрейфа, они унаследовали небольшую часть видового генофонда. Причем утрата части аллелей порой не восполняется появлением новых генетических факторов в ходе мутационного процесса. Оказавшись в условиях антропогенного прессинга, такие популяции, не имея запаса генетической прочности, оказываются в более уязвимом положении, чем другие виды сообщества. Часто бывает так, что вид, занесенный в охранные списки отдельных регионов, в целом широко распространен и в отдельных частях ареала достигает большой численности, соответственно не нуждается в охране. Однако такое кажущееся благополучие может смениться в ряде мест депрессивным состоянием. В условиях нормально колеблющейся среды такое вымирание локальных периферийных группировок легко восполняется притоком особей из центральных областей. Но в настоящее время из-за разрушения биокоридоров такое поддержание стабильности вида все более оказывается неосуществимым. Причем сама по себе редкость встречаемости вида в регионе может служить только косвенным аргументом, так как она может быть вызвана случайным заносом особей из соседних благополучных частей ареала и приравнена к попытке освоения новых территорий. Иной вариант возникает, когда дело касается исконных реликтовых популяций. Для оценки их жизнеспособности, помимо традиционных демографических характеристик, необходимы глубокие знания о состоянии популяционных генофондов, включая оценку аллельного и генотипического разнообразия, степени мутагенной нагрузки и адаптационных перестроек на генетическом уровне. Эти сведения должны стать серьезным аргументом для принятия решений.
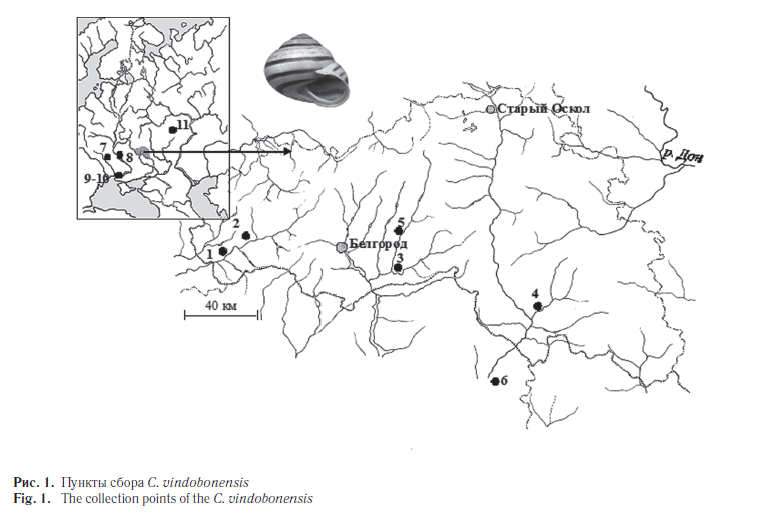
Одним из таких уязвимых видов является реликтовый наземный брюхоногий моллюск Cepaea vindobonensis Fer. [1] (австрийская улитка), известный из плейстоценовых отложений Европы. Его современный ареал охватывает Юго-Восточную Европу, Крым и Северный Кавказ [1]. Наши исследования в основном проводились на южном макросклоне Среднерусской возвышенности (Белгородская и Харьковская области), где проходит северо-восточная граница естественного ареала этого вида. На данной территории улитки обитают в реликтовых сообществах доледникового и послеледникового периодов, таких как меловые боры и нагорные дубравы, а также они встречаются на сухих, хорошо прогреваемых склонах, на меловых обнажениях и суходольных лугах [2]. Вид занесен в Красную книгу Белгородской области [3].
Стоит отметить, что изучению популяционной структуры данного вида был посвящен ряд работ, проведенных с учетом признаков раковины и охватывающих центральные и западные участки видового ареала [4–13]. В указанных публикациях приводятся данные о зависимости метрических и окрасочных признаков раковины этого моллюска от микроклиматических условий естественной и урбанизированной среды. Кроме того, с использованием молекулярных маркеров ДНК (RAPD) была изучена одна континуальная популяция C. vindobonensis, обитающая в условиях города Николаева на юге Украины [14]. В наших предыдущих исследованиях были получены предварительные данные о популяционной структуре австрийской улитки на юге Среднерусской возвышенности, полученные с помощью конхиологических признаков и аллозимов [15].
Цель работы: на основании селективно значимых локусов изоферментов и нейтральных маркеров ДНК (RAPD, ISSR) оценить состояние популяционных генофондов C. vindobonensis в условиях северо-восточной части ареала в природоохранных целях.
Материал и методика
Материалом для исследования послужили образцы тканей особей C. vindobonensis, хранящиеся в криобанке, созданном в лаборатории популяционной генетики и генотоксикологии НИУ «БелГУ». Выборки особей из популяций C. vindobonensis осуществлялись во время экспедиции с 2006 по 2010 год из шести пунктов юга Среднерусской возвышенности. Для сопоставления нами были взяты выборки из западной части ареала вида (пункты с 7-й по 10-й), а также адвентивная группа из г. Пензы (пункт 11) (табл. 1, рис. 1). Всего по аллозимам было исследовано 999 особей, а по ДНК-маркерам — 488 особей.

Экстракцию аллозимов проводили из ноги моллюсков путем замораживания при –80 °C с последующим оттаиванием и механическим измельчением в 0,05 М трис-НСl-буфере (pH 6,7). Электрофорез изоферментов проводился в 10 % полиакриламидном геле в камере VE-3 (Helicon, Russia). Гелевый трис-НCl-буфер (концентрирующий гель pH 6,7, разделяющий гель pН 8,9); электродный трис-глициновый-буфер (pН 8,3). Окрашивание блоков на выявление неспецифических эстераз проводилось в субстратной смеси: трис-HCl (рH 7,4), α-нафтилацетат, прочный красный TR. В качестве генетических маркеров использовались три локуса неспецифических эстераз: EST1 — димер с двумя аллелями, EST2 — димер с двумя аллелями и EST8 — мономер с тремя аллелями [15].
Анализ изменчивости по ДНК-маркерам проводили с использованием полимеразной цепной реакции методом RAPD (Random amplified polymorphic DNA) [18] и ISSR (Inter simple sequence repeats) [19]. Для анализа использовали два праймера: ОРА10 (5΄-GTGATCGCAG-3΄; метод RAPD), SAS3 (5΄-GAGGAGGAGGAGGC-3΄, метод ISSR). Амплификацию проводили в термоциклере MyCycler (Bio-Rad, США). Реакцию проводили в 20 мкл смеси, содержащей 20 нг геномной ДНК, ПЦР-буфер (10 мМ трис-НСl (рН 8,3), 50 мМ КСL, 2 мМ MgCl2), 0,25 мМ dNTP, 0,5 мкМ праймера, 1 единицу Taq ДНК-полимеразы (ингибированной для горячего старта). Реакция проходила в следующих условиях: «горячий старт» — 2 мин/94 °C, 35 циклов (денатурация — 45 с/94 °C, отжиг праймера — 15 с/T °C, синтез — 1 мин/72 °C), дополнительный синтез — 10 мин/72 °C. Для праймера ОРА10 температура отжига T = 36 °C, для SAS3 — Т = 55 °C. Продукты ПЦР разделяли с помощью электрофореза в 2 % агарозном геле с использованием ТАЕ-буфера (охлажденного до + 4 °C), 10 В/см — 45 мин. Блоки окрашивали бромистым этидием.
По картинам амплифицированных фрагментов, полученных в ходе электрофореза, составляли бинарные матрицы, где присутствие полосы обозначалось как «1» (аллель p), отсутствие «0» (аллель q). Ввиду того что при использовании метода RAPD могут появляться неспецифические продукты амплификации, для анализа мы использовали четко просматриваемые и воспроизводимые ампликоны. Критерием воспроизводимости было повторное проявление амплификонов после ПЦР у одних и тех же исследуемых особей. По праймеру ОРА1 нами выделено 17 локусов, по SAS3 — 18 локусов. Полученные ДНК-паттерны и их расшифровка приведены на рисунке 2.

Обработка полученных данных проводилась с использованием программ GenAlExv.6.5 [20], POPGENE32 [21], MEGA6 [22].
Результаты
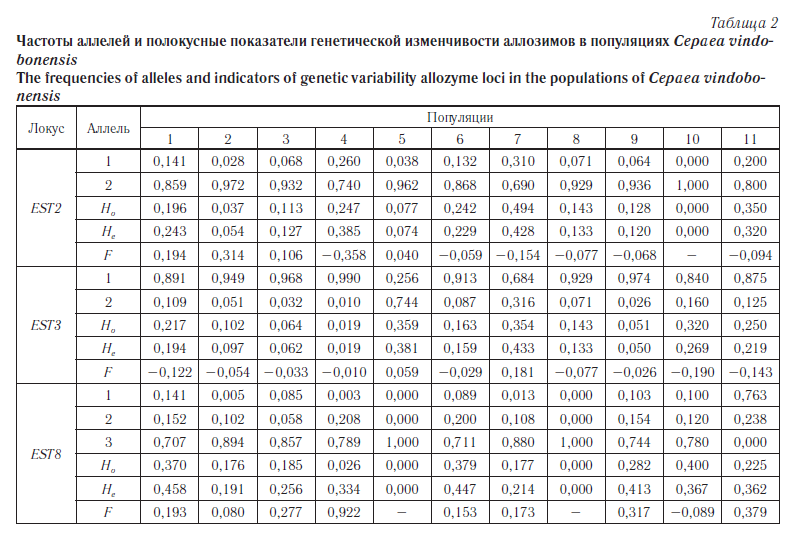
Первым этапом наших исследований была оценка уровня генетической гетерогенности изучаемых популяций C. vindobonensis. Частоты аллелей и показатели генетической изменчивости по используемым локусам аллозимов представлены в таблицах 2 и 3, а по ДНК-маркерам — в таблице 4.

Ввиду того что для оценки состояния популяционных генофондов C. vindobonensis были использованы выборки ограниченной численности, содержащие лишь небольшую часть популяционного аллелофонда, в каждой группе было оценено общее количество мультилокусных генотипов (NMLG) и число уникальных мультилокусных генотипов (NMLG-1), т. е. тех комбинаций, которые были отмечены в одной-единственной выборке. В дальнейшем, основываясь на распределении частот мультилокусных генотипов, для каждой популяции было вычислено потенциальное генетическое разнообразие, ожидаемое при увеличении объема выборки до бесконечности (Nmax). Анализ проводили с помощью двух непараметрических методов: метод Chao1-bc (bias-corrected form for the Chao1) [23] и метод «сломанного ножа» первого порядка (1st order jackknife) [24]. Все расчеты были проведены с помощью программы SPADE [25]. Результаты анализа мультилокусных генотипов представлены в таблице 5.

Следующим этапом наших исследований была оценка уровня подразделенности популяций C. vindobonensis на изучаемых территориях. Для описания генетической дифференциации популяций на разных уровнях иерархической структуры по аллозимам была применена модель С. Райта [26] (табл. 6). Кроме того, уровень разобщенности популяций был вычислен на основе модели М. Неи [27] (табл. 7), а также с помощью анализа молекулярной дисперсии (AMOVA) [28] (табл. 8, 9). Результаты кластерного анализа на основе генетических расстояний невзвешенным парногрупповым методом (UPGMA) представлены на рисунке 3, а график зависимости уровня потока генов от географических дистанций между группами — на рисунке 4.





На заключительном этапе нами была проведена оценка эффективной численности популяций C. vindobonensis с использованием различных моделей. Первый способ расчета был проведен на основании коэффициента инбридинга: Ne = N / (1 + F) [29]. Для получения сопоставимых данных мы вычислили отношение эффективного размера выборки к ее общему объему (см. табл. 3).
Второй способ расчета основан на коэффициентах линейной функции между попарными оценками потока генов (Nm) и географического расстояния между популяциями (Dg): logNm = a + b · logDg. Эффективную численность популяции (для всех исследованных популяций в целом) вычисляли как Ne = 10a, где а — коэффициент, полученный в уравнении [30]. Используемые уравнения приведены на рисунке 4. Полученные результаты приведены в таблице 10.

Еще один примененный нами способ вычисления эффективного размера популяций основан на модели, в которой учитываются значения индекса подразделенности популяции [31]:

Ввиду того что для определения степени подразделенности популяций в данной работе нами вместе с индексом Fst было задействовано два других интегральных и взаимозаменяемых показателя Gst и Фst, мы сочли возможным модифицировать указанную формулу, внося в нее поочередно значения этих индексов. Результаты приведены в таблице 11.

Обсуждение
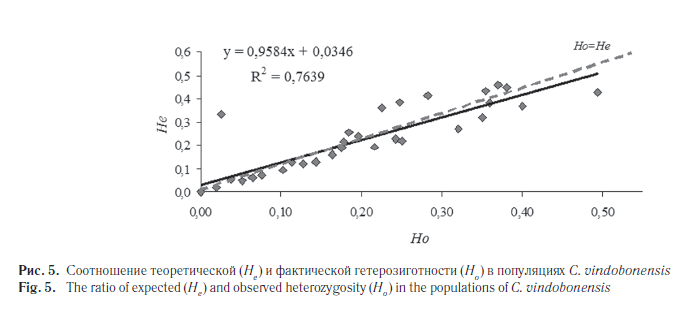
Согласно полученным данным по аллозимам (см. табл. 2) в 30,3 % случаев наблюдается достоверный дефицит гетерозигот[2], в остальных вариантах достоверных отличий между фактической и теоретической гетерозиготностью не зафиксировано. Об этом же свидетельствуют данные, приведенные на рисунке 5, где намечается незначительный тренд в сторону дефицита гетерозигот, при этом коэффициент регрессии оказался равным 0,958 ± 0,195 (при p = 0,05).
Согласно данным, приведенным в таблице 3, среди исследуемых шести популяций юга Среднерусской возвышенности (пункты 1–6) наименьший уровень изменчивости и повышенное значение коэффициента инбридинга по изоферментным локусам отмечены в группах из пунктов «Валуйки» (№ 4), «Ржевка» (№ 5) и «Хотмыжск» (№ 2). За пределами Среднерусской возвышенности самой мономорфной оказалась группа с острова Хортица (№ 8). В последнем случае низкие показатели генетической изменчивости возможны из-за обособленности и малочисленности островной группы. Наиболее полиморфными в восточной части ареала являются естественные популяции из пунктов «Головчино» (№ 1) и «Купянск» (№ 6), а в западной части — популяция из пункта «Житомир» (№ 7). Также весьма высокими показателями генетической изменчивости отличается адвентивная колония из г. Пензы (№ 11). Анализ мультилокусной изменчивости по аллозимам во многом подтвердил эти выводы (см. табл. 5). Наибольшее фактическое и потенциальное генетическое разнообразие отмечено в пунктах 1, 3, 6 и 7. Также в пунктах 7 и 11 отмечено наибольшее количество уникальных генотипов (NMLG-1). Самой однообразной оказалась группа с острова Хортица (№ 8).
Судя по усредненным по совокупности ДНК-локусов показателям генетической гетерогенности (см. табл. 5), наиболее мономорфными оказались популяции «Ржевка» (№ 5) и «Купянск» (№ 6). В отношении пятой группы такой результат является закономерным, так как по изоферментным маркерам здесь также наблюдалось снижение аллельного разнообразия [3]. Однако шестая группа по аллозимам отличалась повышенной изменчивостью. Из популяций, обитающих за пределами Среднерусской возвышенности, самой мономорфной оказалась адвентивная популяция из г. Пенза (№ 11). Полученный результат выглядит несколько неожиданным, так как по аллозимам эта группа выделяется среди остальных большей гетерогенностью. Кроме того, согласно полученным ранее данным эта колония отличалась высоким разнообразием цветовых вариантов раковины [15]. В этой связи мы полагаем, что этот случай еще раз демонстрирует различие генетических процессов, протекающих в кодирующей части генома, подверженных естественному отбору, и подчиняющихся генетико-автоматическим законам в остальной части «молчащей» ДНК. Ранее мы уже пытались объяснить значительную морфологическую изменчивость этой колонии особыми микроклиматическими условиями городской среды, а также конкурентным вакуумом и отсутствием хищников [15]. В формате этих рассуждений повышенная мономорфность, выявленная по ДНК-маркерам, вероятно, есть результат генетического дрейфа, вызванного «эффектом основателя».
В отношении отдельных ДНК-локусов наиболее полиморфными среди RAPD-маркеров являются локусы 3, 5 и 16, а среди ISSR-маркеров более изменчивыми оказались локусы 1, 8 и 15 (табл. 7). В группу более мономорфных локусов по праймеру OPА10 вошли локусы 8, 9, 13, 14 и 17, а по праймеру SAS3 — локусы 2, 5, 7, 9, 11, 13, 17 и 18. Примечательно, что в среднем гетерозиготность по RAPD-локусам (Ht = 0,208 ± 0,035, Hs = 0,136 ± 0,020) достоверно не отличается от гетерозиготности по ISSR-локусам (Ht = 0,192 ± 0,041, Hs = 0,157 ± 0,031).
В целом стоит отметить, что уровень изменчивости популяций C. vindobonensis на юге Среднерусской возвышенности не уступает, а в некоторых случаях превосходит аналогичный уровень изменчивости в западных группах, что, полагаем, является положительным сигналом в плане оценки жизнеспособности популяций этого вида.
Оценка степени дифференциации популяций по аллозимным локусам с использованием F-статистики С. Райта в среднем показала довольно большую разобщенность изучаемых групп улиток (см. табл. 6). Аналогичную картину мы наблюдаем при сопоставлении данных, полученных на основе анализа молекулярной дисперсии (AMOVA, см. табл. 8). В обоих случаях показатель интенсивности обмена генами между популяциями (Nm) оказался меньше единицы, что согласно «теории эволюции со смещающимся равновесием» нарушает панмиксию между популяциями [31]. Об этом же свидетельствуют и относительно высокие значения коэффициента инбридинга Fit. При этом нужно отметить, что наибольший вклад в межпопуляционное разнообразие, оцениваемое по коэффициенту инбридинга Fst (см. табл. 6), вносит локус EST3. Однако тест на гетерогенность с помощью критерия χ2 достоверного разделения групп по этому локусу не выявил (p = 0,7).
По используемым ДНК-маркерам наибольшая разобщенность отмечается по локусам № 11, 15, 16 (ОРА10) и № 1, 8, 10, 12 (SAS3) (см. табл. 7). Известно, что средние величины Gstсоответствуют уровню генетической дифференциации при селективно-нейтральном процессе. В таком случае локусы с большими значениями Gst, вероятнее всего, могут испытывать действие дизруптивного отбора, а локусы с низкими показателями индекса подразделенности подвержены влиянию стабилизирующего отбора [32]. При этом различия по RAPD-спектрам (Gst = 0,264) оказались выше, чем по ISSR-спектрам (Gst = 0,112).
Анализ молекулярной дисперсии как по аллозимам, так и по ДНК-маркерам продемонстрировал сходную картину. И в том и в другом случае на внутрипопуляционную изменчивость пришлось 26 %, а показатели подразделенности популяций Фst незначительно отличаются от индексов Fst и Gst. Соответственно, уровень потока генов (Nm) составил 0,630–0,676 особи за поколение (см. табл. 8).
Результаты кластерного анализа продемонстрировали явное отличие в расхождении групп по кластерам между дендрограммами, построенными на основе аллозимов и маркеров ДНК (см. рис. 3). При этом в обоих случаях географическое положение популяций не оказывает влияния на схожесть в соотношении частот аллелей и их комбинаций. Так, например, соседние популяции, обитающие в долине реки Ворскла (пункты 1, 2), несмотря на близкое пространственное расположение, оказались, согласно схемам, в разных кластерах. При этом уровень дифференциации между ними по аллозимам составил Фst = 0,124, а по ДНК-маркерам — Фst = 0,174 (p = 0,01) (см. табл. 9). Примечательно, что такой оригинальности мог способствовать антропогенный прессинг. Дело в том, что группа «Хотмыжск» (№ 2) обитает на распахивавшихся ранее пойменных участках, которые заброшены человеком более 30 лет назад. Освоение этой территории, вероятно, происходило из сохранившихся естественных островков пойменной растительности, в которых остались небольшие группы улиток. Испытав так называемый «эффект бутылочного горлышка» и, возможно, «эффект генетической революции» [34], группа стала более мономорфной по сравнению с популяцией «Головчино» (№ 1), обитающей в естественном лесном биотопе. Данный факт, вероятно, свидетельствует о склонности вида к образованию метапопуляционной структуры в условиях урбанизированной территории юга Среднерусской возвышенности [35].
Наиболее оригинальной группой в отношении генетических комбинаций изоферментных маркеров является колония из г. Пензы (№ 11). Именно здесь зафиксирована высокая частота аллеля EST8–1 (0,763). Во всех других популяциях его доля не превышает 0,141. Это явление можно рассматривать либо как следствие дрейфа генов из-за «принципа основателя», либо как результат естественного отбора в городской среде.
По ДНК-маркерам дальше всех дистанцируется группа «Купянск» (№ 6) и группа «ЮТЗ» из г. Николаева (№ 10). Причем последняя популяция значительно отличается не только от удаленных групп, но и от соседней группы, обитающей в том же городе (№ 9). Уровень дифференциации между ними достиг Фst = 0,436 (p = 0,01) (см. табл. 9), что свидетельствует о значительной изоляции колоний улиток в урбанизированной среде. При этом стоит отметить, что полученные нами данные отчасти не согласуются с предположением С.С. Крамаренко [14], согласно которому в городских условиях изучаемая автором группа C. vindobonensis существует в виде множества дискретных, полуизолированных колоний, что отвечает «островной модели» Райта.
Данные кластерного анализа подтверждаются графиками и уравнениями линейной регрессии (см. рис. 4), которые демонстрируют отсутствие корреляции между географическими дистанциями и попарными оценками потока генов как по аллозимам (мантель-тест RM = 0,001, p = 0,518, 9999 перестановок), так и по ДНК-маркерам (RM = –0,085, p = 0,315, 9999 перестановок). Все это говорит о нарушении каналов миграции между изучаемыми группами C. vindobonensis и их длительной изоляции друг от друга.
Расчет эффективной численности популяций C. vindobonensis с помощью коэффициента инбридинга показал, что отношение эффективного размера к общей численности популяции (Ne/N) в целом для вида равно 0,868 ± 0,028 (см. табл. 3), что укладывается в общий диапазон доли Ne, предложенный Кроу и др. [36, 37] [4]. Кроме того, среднее значение доли Ne, полученное дляC. vindobonensis, достоверно превышает аналогичные значения, полученные нами ранее для аборигенных фоновых видов наземных моллюсков, обитающих в районе исследования: Br. fruticum — 0,800 ± 0,021, Ch. tridens — 0,661 ± 0,013 [38, 39], а также для реликтового моллюска Helicopsis striata — 0,720 ± 0,080 [39, 40]. При этом доля эффективной численности C. vindobonensis оказалась сопоставимой с аналогичным показателем у обитающей здесь виноградной улитки Helix pomatia — 0,870 ± 0,043, имеющей высокий жизненный потенциал [41]. Все эти данные косвенно указывает на высокий уровень жизнеспособности изучаемых популяций австрийской улитки.
Сопоставление полученных оценок эффективного размера популяций C. vindobonensis, вычисленных на основе уравнения линейной регрессии, с аналогичными данными по другим видам моллюсков демонстрирует явное уменьшение этого показателя в группах австрийской улитки (табл. 10), хотя рассчитанные доверительные интервалы показывают, что достоверные отличия отсутствуют.
Несколько иной результат был получен нами при вычислении эффективной численности с учетом уровня подразделенности популяций (табл. 11). Согласно полученным данным наибольший эффективный размер популяций имеют Ch. tridens и Br. fruticum. В популяциях C. vindobonensis эффективный размер оказался ниже, чем у этих двух фоновых видов, и выше, чем у H. striata и Н. pomatia, относящихся к уязвимым моллюскам.
Заключение
Таким образом, исходя из приведенных данных, в целом можно констатировать, что с точки зрения генетических параметров по сравнению, например, с уязвимым видом H. striata, обитающего зачастую в одних и тех же сообществах с C. vindobonensis, изучаемые популяции австрийской улитки имеют более высокий жизненный потенциал. Это обеспечено отчасти тем, что C. vindobonensis эвритопный вид. Благодаря полиморфизму популяции этих улиток могут обитать на открытых остепненных склонах, в лесных сообществах и на припойменных участках. Отмечены случаи успешного освоения моллюсками садов и огородов. Тем не менее снижение аллельного разнообразия, повышение коэффициента инбридинга в ряде групп и высокий уровень изоляции популяций C. vindobonensis в северо-восточной части ареала вызывает обеспокоенность и требует корректировки природоохранных мероприятий в отношении этого вида.
Благодарности
Выражаю благодарность Т. Г. Стойко и С. С. Крамаренко за предоставленный материал для анализа.
About the authors
Eduard A. Snegin
Belgorod national research university
Author for correspondence.
Email: snegin@bsu.edu.ru
Dr. Biol. Sci., senior lecturer, Head of the Laboratory of Population Genetics and Genetoxicology Russian Federation
Elena A Snegina
Belgorod national research university
Email: snegin@bsu.edu.ru
Researcher of the Laboratory of Population Genetics and Genetoxicology Russian Federation
References
- Литература
- Шилейко А.А. Наземные моллюски надсемейства Helicoidea. Фауна СССР. Моллюски. — Л.: Наука, 1978. — Т. 3. — Вып. 6. — 384 с. [Shileiko AA. Terrestrial mollusks superfamily Helicidae. Fauna of the USSR. Shellfish. Leningrad: Nauka; 1978;3(6):384. (In Russ).]
- Снегин Э.А. Использование видов наземных моллюсков в качестве индикаторов реликтовых ценозов // Вестник Житомирского педагогического университета. — 2002. — Вып. 10. — С. 128–129. [Snegin EA. The use of species of terrestrial molluscs as a relic cenoses indicators. Vestnik Zhitomirskogo pedagogicheskogo universiteta. 2002;10:128-129. (In Russ).]
- Красная книга Белгородской области. Редкие и исчезающие растения, грибы, лишайники и животные. — Белгород, 2004. — 532 с. [The Red Book of the Belgorod region. Rare and endangered plants, fungi, lichens and animals. Belgorod; 2004. 532 p. (In Russ).]
- Rotarides M. Über die Bändervariationen von Cepaea vindobonensis Fér Zool Anz. 1926;67(½):28-44.
- Jones JS. Environmental selection in the snail Cepaea vindpbonensis in the Lika area of Yugoslavia. Heredity. 1974;32(2):165-170. doi: 10.1038/hdy.1974.20.
- Jones JS. The genetic structure of some steppe populations of the snail Cepaea vindobonensis. Genetica. 1975;45:217-225. doi: 10.1007/BF01517198.
- Sacchi CF. Population ecology of Cepaea nemoralis and C. vindobonensis along the north Adriatic coasts of Italy. Malacologia. 1984;25(2):315-323.
- Хлус Л.М., Хлус К.М. Конхиологичнi особливости буковиньских популяцiй Cepaea vindobonensis Fer. (Geophyla, Helicidae) // Матерiали конф. «Гори I люди (у контекстi сталого развитку)». — Рахiв, 2002. — Т. 2. — С. 522–526. [Khlus LM, Khlus KM. Konkhiologichni osoblivosti bukovin’skikh populyatsii Cepaea vindobonensis Fer. (Geophyla, Helicidae). Materiali konf. “Gori I lyudi (u konteksti stalogo razvitku)” (conference proceedings). Rakhiv; 2002;2:522-526. (In Ukrainian).]
- Honek A. Shell-band color polymorphism in Cepaea vindobonensis at the northern limit of its range. Malacologia. 2003;25:133-140.
- Сверлова Н.В., Кирпан С.П. Фенетична структура популяцій Cepaea vindobonensis (Gastropoda, Pulmonata, Helicidae) на заході України // Наук. зап. Держ. природозн. музею. — Львів, 2004. — Т. 19. — С. 107–114. [Sverlova NV, Kirpan SP. Phenetic Structure of Populations of Cepaea vindobonensis (Gastopoda, Pulmonata; Helicidae) in Western Ukraine. Naukovi Zapiski DPM. 2004;19:107-114. (In Ukrainian).]
- Гураль-Сверлова Н.В., Мартынов В.В. Конхологические особенности популяций Cepaea vindobonensis на территории Донецкой области // Проблемы экологии и охраны природы техногенного региона. — Донецк: Изд-во Донецкого национального ун-та, 2007. — Вып. 7. — С. 85–91. [Gural’-Sverlova NV, Martynov VV. Conchological particular populations of Cepaea vindobonensis on the territory of Donetsk region. In: Problems of Ecology and Nature Protection technogenic region. Donetsk: Publishing House of the Donetsk National University Press; 2007;7:85-91. (In Russ).]
- Крамаренко С.С., Хохуткин И.М., Гребенников М.Е. Особенности фенетической структуры наземного моллюска Cepaea vindobonensis в урбанизированных и природных популяциях // Экология. — 2007. — № 1. — С. 42–48. [Kramarenko SS, Khokhutkin IM, Grebennikov ME. Specific Features of Phenetic Structure of the Terrestrial Snail Cepaea vindobonensis (Pulmonata; Helicidae) in Urbanized and Natural Populations. Russian J of Ecology. 2007;38(1):39-45. (In Russ).] doi: 10.1134/S1067413607010079.
- Ożgo М, Komorowska А. Shell banding polymorphism in Cepaea vindobonensis in relation to habitat in southeastern Poland. Malacologia. 2009;51(1):81-88. doi: 10.4002/040.051.0105.
- Крамаренко С.С. Анализ генетической структуры популяций наземного моллюска Cepaea vindobonensis (Gastropoda, Pulmonata, Helicidae) с использованием RAPD-маркера // Вестник зоологии. — 2009. — Т. 43. — № 5. — С. 449–455. [Kramarenko SS. Analysis of the genetic structure of terrestrial mollusk populations of Cepaea vindobonensis (Gastropoda, Pulmonata, Helicidae) using RAPD-marker. Vestnik zoologii. 2009;43(5):449-455. (In Russ).]
- Снегин Э.А. Оценка жизнеспособности популяций особо охраняемого вида Cepaea vindobonensis (Mollusca, Gastropoda, Pulmonata) в условиях юга лесостепи Среднерусской возвышенности // Вестник КрасГАУ. — 2011. — № 11. — С. 142–148. [Snegin EA. Vitality estimation of the Cepaea vindobonensis (Mollusca, Gastropoda, Pulmonata) especially protected species populations in the conditions of the Central Russian Upland forest-steppe south. Vestnik KrasGAU. 2011a;(11):142-148. (In Russ).]
- Neiber MT, Hausdorf B. Molecular phylogeny reveals the polyphyly of the snail genus Cepaea (Gastropoda: Helicidae). Mol Phyl and Evol. 2015;93:143-149. doi: 10.1016/j.ympev.2015.07.022.
- Neiber MT, Sagorny C, Hausdorf B. Increasing the number of molecular markers resolves the phylogenetic relationship of ‘Cepaea’ vindobonensis (Pfeiffer 1828) with Caucasotachea Boettger 1909 (Gastropoda: Pulmonata: Helicidae). J Zool Syst Evol Res. 2016;54(1):40-45. doi: 10.1111/jzs.12116.
- Welsh J, McClelland M. Fingerprinting genomes using CR with arbitrary primers. Nucleic Acids Res. 1990;18(22):7213-7219. doi: 1093/nar/18.24.7213.
- Zietkiewicz E, Rafalski A, Labuda D. Genome fingerprinting by simple sequence repeat (SSR) — anchored polymerase chain reaction amplification. Genomics. 1994;20(2):176-181. doi: 10.1006/geno.1994.1151.
- Peakall R, Smouse PE. GenAlEx 6: genetic analysis in Excel. Population genetic software for teaching and research. Mol Ecol Notes. 2006;(6):288-295.
- Yeh FC, Yang R, Boyle TJ, et al. POPGENE32, Microsoft Window-based Freeware for Population Genetic Analysis, Version 1.32; Molecular Biology and Biotechnology Centre, University of Alberta: Edmonton, Canada. 2000. http://www.ualberta.ca/~fyeh/popgene_download.html.
- Tamura K, Stecher G, Peterson D, et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0. Mol Phyl and Evol. 2013;30:2725-2729. doi: 10.1093/molbev/mst197.
- Chao A. Species richness estimation. In: Balakrishnan N., Read C.B., Vidakovic B., editors. Encyclopedia of Statistical Science. New York: Wiley; 2005. P. 7907-7916.
- Burnham KP, Overton WS. Estimation of the size of a closed population when capture probabilities vary among animals. Biometrika. 1978;(65):625-633. doi: 10.1093/biomet/65.3.625.
- Chao А, Shen T-J. 2009. SPADE. http://chao.stat.nthu.edu.tw.
- Right S. The genetical structure of populations. Ann Eugenics. 1951;(15):323-354.
- Nei M. Molecular population genetics and evolution. Amsterdam; 1975. 278 p.
- Excoffier L, Smouse PE, Quattro JM. Analysis of molecular variance inferred from metric distances among DNA haplotypes: application to human mitochondrial DNA restriction data. Genetics. 1992;(131):479-491.
- Ли Ч. Введение в популяционную генетику. — М.: Мир, 1978. — 560 с. [Li C. First course in population genetics. The Boxwood Press. Pacific Grove. California. 1976. 631 p.]
- Slatkin M. Isolation by distance in equilibrium and non-equilibrium populations. Evolution. 1993;47(1):
- -279. doi: 10.2307/2410134.
- Wright S. Random drift and shifting balance theory of evolution. Mathematical Topics in Population Genetics. Berlin: Springer Verlag; 1970. P. 1-31. doi: 10.1007/978-3-642-46244-3_1.
- Динамика популяционных генофондов при антропогенных воздействиях / Под ред. Ю. П. Алтухова. — М.: Наука, 2004. — 619 с. [The dynamics of population gene pools under anthropogenic influences. Ed Yu.P. Altukhov. Moscow: Nauka; 2004. P. 619. (In Russ).]
- Nei M. Genetic distance between populations. Am Nat. 1972;106(949):283-292. doi: 10.1086/282771.
- Майр Э. Зоологический вид и эволюция. — М.: Мир, 1968. — 398 c. [Mayr E. Animal species and evolution. London: Oxford University Press; 1965. 797 p.]
- Hanski I. Metapopulation Ecology. Oxford: Oxford University Press; 1999. 328 p.
- Crow JF, Morton NE. Measurement of gene frequency drift in small population. Evolution. 1955;9:202-214. doi: 10.2307/2405589.
- Crow JF, Kimura M. An introdution to population genetics theory. N.Y.: Harpers and Row; 1970. 591 p.
- Снегин Э.А. Генетическая структура популяций модельных видов наземных моллюсков в условиях урбанизированного ландшафта на примере Сhondrula tridens Müll. (Gastropoda, Pulmonata) // Экологическая генетика. — 2011. — Т. IX. — № 2. — С. 54–64. [Snegin EA. The genetic structure of model species populations of terrestrial mollusks in conditions of urbanized landscape using the example of Chondrula tridens Müll (Gastropoda, Pulmonata). Russian J of Genetics: Applied Research. 2012;9(2):160-170.] doi: 10.1134/S2079059712020128.
- Снегин Э.А. Пространственные и временные аспекты эколого-генетической структуры популяций беспозвоночных животных (на примере наземных моллюсков и насекомых юга Среднерусской возвышенности): Дис. … д-ра биол. наук. — Белгород: НИУ БелГУ, 2012. — 394 с. [Snegin EA. Spatial and temporal aspects of the ecological and genetic structure of populations of invertebrates (for example, terrestrial mollusks and insects of Southern Central Russian Upland. [dissertation]. Belgorod: BSU; 2012. P. 394 (In Russ).]
- Снегин Э.А., Сычев А.А. Оценка жизнеспособности популяций особо охраняемого вида Helicopsis striata Müller (Mollusca, Gastropoda, Pulmonata) в условиях юга Среднерусской возвышенности // Теоретическая и прикладная экология. — 2011. — № 2. — С. 84–93. [Snegin EA, Sichev AA. Assessment of the viability of populations of specially protected species Helicopsis striata Müller (Mollusca, Gastropoda, Pulmonata) in the conditions of the Southern Upland. Teoreticheskaya i prikladnaya ekologiya. 2011;(2):84-93. (In Russ).]
- Снегин Э.А., Артемчук О.Ю. Морфогенетический анализ популяций Helix pomatia L. (Pulmonata, Helicidae) юго-восточной и восточной части современного ареала // Экологическая генетика. — 2014. — Т. XII. — № 4. — С. 25–37. [Snegin EA, Artemchuk OYu. Morphogenetic analysis of Helix pomatia L. (Pulmonata, Helicidae) populations from south-eastern and eastern parts of the modern area. Russian J of Genetics: Applied Research. 2016;6(2):152-162.] doi: 10.1134/S207905971602012X.
- Снегин Э.А. Оценка состояния популяционных генофондов наземных моллюсков в условиях влияния горнообогатительных комбинатов на примере Bradybaena fruticum Müll. (Gastropoda, Pulmonata) // Экологическая генетика. — 2010. — Т. VIII. — № 2. — С. 45–55. [Snegin EA. Assessment of the state of population gene pools of terrestrial mollusks in conditions of influence of ore dressing combines from the example of Bradybaena fruticum Müll. (Gastropoda, Pullmonata). Russian J of Genetics: Applied Research. 2011;1(5):379-389.] doi: 10.1134/S2079059711050133.
- Снегин Э.А. Анализ генетической изменчивости популяций наземного моллюска Сhondrula tridens Müll. (Gastropoda, Pulmonata) с использованием RAPD- и ISSR-маркеров // Экологическая генетика. — 2013. — T. XI. — № 3. — С. 37–47. [Snegin EA. Analysis of genetic variability in populations of a terrestrial snail Chondrula tridens Müll. (Gastropoda, Pulmonata), based on the RAPD and ISSR markers. Russian J of Genetics: Applied Research. 2014;4(5):444-454.] doi: 10.1134/S207905971405013X.
- Снегин Э.А. Оценка состояния популяционных генофондов особо охраняемого вида Helicopsis striata (Mollusca, Gastropoda, Pulmonata) на основе ДНК-маркеров // Экологическая генетика. — 2015. — Т. XIII. — № 3 — С. 28–39. [Snegin EA. Assessment of the state population gene pool of specially protected species Helicopsis striata (Mollusca, Gastropoda, Pulmonata) using DNA-markers.Ecologicheskaya Genetika. 2015;13(3):28-39. (In Russ).].
Supplementary files
















