Lactoginal for correction of abnormal vaginal microbiocenosis in pregnant woman with cervical cerclage: clinical case and literature review
- Authors: Tapilskaya N.I1, Savicheva A.M2, Shipitsyna E.V2
-
Affiliations:
- St Petersburg State Pediatric Medical University
- FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott”
- Issue: Vol 65, No 6 (2016)
- Pages: 89-95
- Section: Articles
- URL: https://journals.eco-vector.com/jowd/article/view/5884
- DOI: https://doi.org/10.17816/JOWD65689-95
- ID: 5884
Cite item
Full Text
Abstract
The present paper describes for the first time a case of using the preparation of vaginal lactobacilli Lactoginal (strain Lactobacillus rhamnosus Lcr35) for correction of vaginal microflora disturbance, associated with cervical cerclage in pregnant woman with a history of pregnancy miscarriage. Administration of the probiotic lactobacilli preparation up to the delivery resulted in steady normalization of the vaginal miсrobiocenosis, which might have, to a certain extent, contributed to its normal course and delivery. The obtained results are discussed in the context of literature data.
Full Text
Введение
Недостаточность шейки матки, или истмико-цервикальная недостаточность (ИЦН), является одной из ведущих причин невынашивания беременности во втором и третьем триместрах и характеризуется как ее бессимптомное укорочение и расширение во втором или начале третьего триместра беременности, приводящее к разрыву плодного пузыря и потере беременности или преждевременным родам [1]. В дополнение к функции механического поддержания плода шейка матки играет важную роль в защите плода от восходящей инфекции благодаря антимикробному действию цервикальной слизистой пробки [1]. Данные литературы свидетельствуют, что около 80 % случаев острой ИЦН могут быть ассоциированы с внутриамниотической инфекцией [2].
Один из наиболее важных методов лечения цервикальной недостаточности — хирургический — представляет собой наложение швов на шейку матки, или цервикальный серкляж. В недавнем метаанализе эффективности цервикального серкляжа для минимизации репродуктивных потерь установлено, что его применение снижает частоту преждевременных родов у женщин высокого риска, не влияя, однако, существенным образом на частоту перинатальной смертности или неонатальной заболеваемости [3]. Цервикальный серкляж может быть рекомендован пациенткам с одноплодной беременностью, имеющим в анамнезе преждевременные роды до 34-й недели беременности и короткую шейку матки (≤ 25 мм) до 22–24 недель беременности [4, 5].
В последние годы изучается возможность использования пробиотических бактерий, в первую очередь лактобацилл, для профилактики случаев невынашивания беременности, связанных с инфекционным фактором. Полагают, что пробиотические лактобациллы способны восполнять дефицит вагинальных лактобацилл и посредством целого ряда механизмов защищать половые пути женщины от инфекции [6].
В данной работе описывается случай благополучного разрешения беременности после коррекции нарушения микробиоза влагалища с применением штамма пробиотических вагинальных лактобацилл Lactobacillus rhamnosus Lcr35 (Лактожиналь) у женщины с наложенным швом на шейку матки, и полученные результаты анализируются в свете данных литературы.
Клинический случай
Пациентка 37 лет, соматически здорова, соматическая и онкологическая наследственность не отягощена. Менструации с 12 лет, установились сразу, по 3–4 дня через 28 дней, умеренные безболезненные. Половая жизнь в браке с 20 лет, брак первый, муж соматически здоров. До момента первой планируемой беременности в течение 6 лет до 2010 года принимала комбинированные оральные контрацептивы.
Из анамнеза известно, что в 2010 году обращалась на консультативный прием к акушеру-гинекологу с целью подготовки к планируемой беременности, при выполнении ультразвукового исследования органов малого таза выявлен полип цервикального канала, пациентка направлена в стационар для выполнения гистероскопического исследования, полипэктомии. Инвазивное вмешательство (гистерорезектоскопия, полипэктомия, выскабливание цервикального канала и стенок полости матки) — без особенностей, проводилась периоперационная антибиотикопрофилактика (цефазолин 2,0 г в/в).
Через 4 месяца после выполнения гистероскопии наступила планируемая беременность, которая в 20 недель закончилась излитием околоплодных вод и самопроизвольным абортом. Вторая беременность наступила в 2012 году, которая закончилась преждевременными родами в сроке гестации 24 недели (новорожденный умер в первые сутки жизни). Через 2 года третья беременность — неразвивающаяся в сроке 8 недель. Во всех беременностях диагностирован лабораторно подтвержденный генетически полноценный плод.
Обратилась к нам с целью планирования и подготовки к следующей беременности. Обследована амбулаторно. По данным молекулярно-генетического исследования на полиморфизм генов, ассоциированных с наследственной тромбофилией (II и V факторы свертываемости крови), метаболизмом фолиевой кислоты (MTHFR, MTR) и особенностью иммунного ответа, установлена гомозиготная мутация (С/С) в положении гена А592С интерлейкина 10-го типа (по данным литературы, гомозиготный полиморфизм в гене IL-10 ассоциирован с повышенным риском преждевременного разрыва плодных оболочек [7]).
При исследовании на инфекции, передаваемые половым путем, патогенных микроорганизмов не выявлено. Проведено исследование микробиоценоза влагалища с использованием теста Фемофлор-16 (ООО «НПО ДНК-Технология», Москва), которое показало доминирование лактобациллярной микрофлоры (заключение — нормоценоз).
На этапе предгравидарной подготовки назначен Фемибион I (фолатная фортификация) и микронизированный прогестерон (Утрожестан, Безен, Франция) по 200 мг 2 раза в сутки с 16 по 25-й день менструального цикла в цикле планируемой беременности. Через 2 месяца наступила спонтанная беременность, продолжен прием микронизированного прогестерона и поливитаминов. В первом триместре гестации беременность протекала физиологически. В 16 недель в плановом порядке выполнена цервикометрия, установлена ИЦН: цервикальный канал длиной 24 мм, внутренний зев воронкообразной формы открыт на 12 мм. Микронизированный прогестерон продолжен по 400 мг в сутки до 36 недель беременности.
С целью пролонгирования беременности выполнена хирургическая коррекция ИЦН путем наложения шва на шейку матки мерсиленовой лентой (Mersilene tape, Johnson & Johnson, США). В последующем госпитализаций в акушерский стационар не было.
Через 10 дней после наложения шва проведено исследование микробиоценоза влагалища с использованием теста Фемофлор-16 (ООО «НПО ДНК-Технология», Москва). Исследование показало большое количество анаэробных бактерий при дефиците лактобациллярной микрофлоры (заключение — умеренный анаэробный дисбиоз). Назначен Лактожиналь (Безен, Франция) 2 раза в день 2 недели, далее 1 раз в день до родов. Через 10 дней после начала лечения проведено контрольное исследование с использованием теста Фемофлор-16, которое показало доминирование лактобациллярной микрофлоры (заключение — нормоценоз) (рис. 1). Такой же результат был получен при повторном (через 3 месяца) исследовании микробиоценоза влагалища.
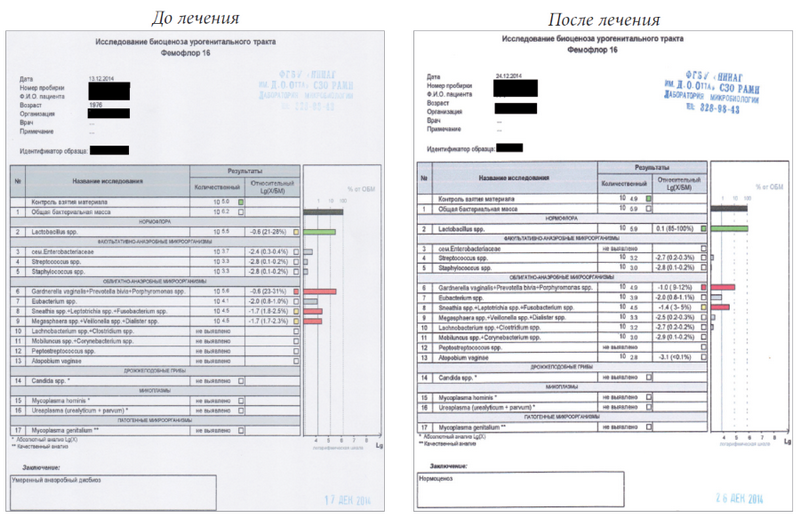
Рис. 1. Результаты исследования микробиоценоза влагалища с использованием теста Фемофлор-16 у беременной женщины с наложенным швом на шейку матки (до лечения и через 10 дней после начала лечения препаратом Лактожиналь)
Fig. 1. Results of analysis of the vaginal microbiocenosis using the test Femoflor-16 in pregnant woman with cervical cerclage (before treatment and 10 days post treatment)
Циркулярный шов снят амбулаторно в 38 недель и 3 дня, в 39 недель и 6 дней развилась спонтанная родовая деятельность. Роды через естественные родовые пути плодом мужского пола, масса плода 3400 г, рост 53 см.
Обсуждение
В нашей работе впервые описан случай применения препарата Лактожиналь, содержащего вагинальные лактобациллы Lactobacillus rhamnosus Lcr35, для коррекции нарушения микробиоценоза влагалища, ассоциированного с наложением шва на шейку матки у беременной женщины с невынашиванием беременности в анамнезе. Применение пробиотических лактобацилл вплоть до родов позволило достичь стойкой нормализации микробиоза влагалища, что, по нашему мнению, в той или иной мере способствовало нормальному течению и благополучному разрешению беременности.
Цервикальный серкляж за многие годы его применения доказал свою эффективность при лечении ИЦН [3]. В качестве альтернативы серкляжу рассматривается цервикальный пессарий, который имеет определенные преимущества, такие как простота и неинвазивность. Однако работ, оценивающих эффективность цервикального пессария для лечения ИЦН, очень мало и их результаты противоречивы. При проведении недавнего метаанализа эффективности цервикального пессария было подчеркнуто, что необходимы дальнейшие рандомизированные исследования для формирования доказательной базы, позволяющей рекомендовать применение пессария в лечении ИЦН [8]. Интравагинальное введение прогестерона также рассматривается как эффективный подход к снижению показателя преждевременных родов при длине шейки матки ≤ 25 мм, установленной при ультразвуковом исследовании в средних сроках беременности [9]. Необходимо отметить, однако, что наличие признаков преждевременных родов при короткой шейке матки может являться показанием для терапии прогестероном, но не цервикального серкляжа, для которого должен также присутствовать критерий невынашивания беременности в анамнезе [5]. В настоящее время нет данных, обосновывающих одновременное применение цервикального серкляжа и вагинального прогестерона [10].
Применение цервикального серкляжа может вызывать ряд осложнений, включая осложнения инфекционного характера. В рандомизированных клинических исследованиях было показано, что цервикальный серкляж ассоциирован с удвоенным риском послеродовой лихорадки, увеличением числа случаев родоразрешения путем операции кесарева сечения, необходимостью использования токолитиков [11]. Осложнениями после цервикального серкляжа могут быть сепсис, геморрагии, преждевременный разрыв плодных оболочек, цервикальная дистоция, разрыв шейки матки во время родов [12]. Необходимо отметить, однако, что частота и характер осложнений существенно зависят от того, выполняется ли цервикальный серкляж профилактически или экстренно (при расширении цервикального канала шейки матки в отсутствие сокращений матки). Важность учета инфекционного фактора при ведении женщин с ИЦН в анамнезе отражена в некоторых международных рекомендациях, подчеркивающих необходимость (при первом пренатальном визите) анализа отделяемого влагалища на бактериальный вагиноз и в случае его выявления — лечения [5].
До недавнего времени считалось, что ни один тип шовного материала, используемого для цервикального cеркляжа, не имеет превосходства над другими типами [4, 5]. Для выполнения цервикального cеркляжа могут быть использованы как моноволоконные, так и мультиволоконные плетеные шовные материалы, при этом мультиволоконные плетеные материалы используются примерно в 80 % случаев [13]. Недавно L.M. Kindinger et al. (2016) исследовали связь между применением определенного вида шовного материала и исходом беременности путем ретроспективного анализа 678 случаев применения цервикального серкляжа у беременных женщин в 5 университетских клиниках в Великобритании [13]. Результаты показали, что цервикальный серкляж, выполненный с использованием мультиволоконного плетеного шовного материала, был ассоциирован с повышенным риском внутриутробной смерти плода (в три раза) и повышенным риском преждевременных родов (в два раза) по сравнению с серкляжем, выполненным с использованием моноволоконного шовного материала. Для изучения возможных биологических основ этой связи авторы также провели проспективное рандомизированное сравнение двух типов шовных материалов. Было показано, что использование мультиволоконного плетеного шовного материала (именно такой тип шовного материала был использован в описанном нами клиническом случае) запускало быстрое и устойчивое изменение микрофлоры влагалища в сторону снижения количества лактобацилл и увеличения количества условно-патогенных микроорганизмов, сопровождающееся повышением уровня провоспалительных цитокинов во влагалище, чего не наблюдалось при использовании моноволоконных материалов. Авторы предположили, что причиной повышенного риска неблагоприятных исходов беременности при использовании мультиволоконных плетеных шовных материалов может быть нарушение микрофлоры влагалища и ассоциированное с ним воспаление.
Известно, что нормальная микрофлора влагалища играет важную роль в неспецифической защите репродуктивных органов женщины от патогенных микроорганизмов. Основным компонентом нормальной микрофлоры влагалища у большинства женщин репродуктивного возраста являются лактобациллы — грамположительные факультативно анаэробные или микроаэрофильные (реже облигатно анаэробные) бактерии семейства Lactobacillaceae. Важнейшим механизмом антимикробной защиты является продукция лактобациллами молочной кислоты путем ферментации гликогена, накапливаемого в эпителиальных клетках под влиянием эстрогенов. Молочная кислота обеспечивает низкое значение рН влагалища и ограничивает тем самым размножение патогенных и потенциально патогенных микроорганизмов. Кроме молочной кислоты, лактобациллы влагалища синтезируют другие антимикробные вещества, такие как перекись водорода и бактериоцины — специфические белки, подавляющие жизнедеятельность других бактерий путем повреждения их цитоплазматических мембран. Еще одним способом, посредством которого нормальная микрофлора влагалища осуществляет антагонизм в отношении других бактерий, является конкуренция за пищевые субстраты и сайты адгезии к эпителию влагалища [6].
Защитная функция лактобацилл приобретает особое значение во время беременности, так как нарушения нормальной микрофлоры влагалища, такие как бактериальный вагиноз и аэробный вагинит, ассоциированы с рядом инфекционных осложнений беременности и могут приводить к самопроизвольному выкидышу и преждевременным родам [14–16]. Патофизиологические механизмы, определяющие неблагоприятное влияние нарушенной микрофлоры влагалища на течение и исход беременности, до сих пор полностью не ясны. Полагают, что воспаление, ассоциированное с избыточным ростом условно-патогенных микроорганизмов, может нарушать физиологический иммуногормональный фон в ходе имплантации и раннего развития эмбриона и приводить к выкидышу (на ранних сроках беременности) или преждевременным родам (на поздних сроках беременности). Кроме того, микроорганизмы, населяющие нижние отделы генитального тракта при бактериальном вагинозе, могут восходящим путем проникать в полость матки и достигать децидуальной оболочки. Это может запускать целый ряд процессов, вовлеченных в индукцию преждевременных родов, включая увеличение продукции лейкоцитов, продукцию цитокинов, синтез простагландинов в амнионе, хорионе и миометрии, сокращения матки, расширение цервикального канала шейки матки, что, в свою очередь, способствует дальнейшему проникновению микроорганизмов в полость матки [17–19]. Далее ассоциированные с бактериальным вагинозом бактерии могут вырабатывать литические ферменты, такие как сиалидазы и муциназы, которые могут ослаблять защитную цервикальную слизь и способствовать бактериальной инвазии верхних отделов генитального тракта [20].
В последние годы пробиотические микроорганизмы (в большинстве своем лактобациллы) находят все более широкое применение во многих областях медицины, включая акушерство и гинекологию. Пробиотики не только обладают свойствами эндогенной микрофлоры, дефицит которой они часто восполняют, но и могут выполнять ряд дополнительных функций. Свое антимикробное действие пробиотики осуществляют путем продукции антимикробных молекул и конкурентного ингибирования патогенов (конкуренция за сайты адгезии и ресурсы). Пробиотики способствуют усилению барьерной функции слизистых оболочек посредством секреции муцинов и повышения плотности сочленения эпителиальных клеток. Также хорошо известна иммуномодулирующая активность пробиотиков [6]. Эффективность пробиотических лактобацилл для восстановления нормальной микрофлоры влагалища при беременности была показана в ряде работ [21, 22]. Недавно была также продемонстрирована эффективность длительного (в течение 12 недель) использования вагинальных лактобацилл Lactobacillus rhamnosus BMX-54 во втором триместре беременности для профилактики нарушений микробиоценоза влагалища и ограничения влияния нарушенной микрофлоры влагалища на длину и раскрытие шейки матки, а также расположение плаценты [19]. Так, у женщин, не получавших пробиотик, с прогрессированием беременности наблюдалась статистически значимая тенденция к увеличению числа случаев роста условно-патогенной микрофлоры, повышения рН влагалища, положительного аминного теста и патологических выделений из влагалища. У этих женщин наблюдались статистически значимые изменения в длине (в сторону уменьшения) и раскрытии (в сторону увеличения) шейки матки, а также тенденция к более низкому расположению плаценты. Напротив, у женщин, получавших препарат лактобацилл, указанные изменения не регистрировали, за исключением длины цервикального канала, которая так же, как и у женщин контрольной группы, уменьшалась к третьему триместру беременности. Необходимо отметить, однако, что, несмотря на продемонстрированный потенциал эффективности пробиотических лактобацилл при беременности, имеющихся на сегодняшний день данных недостаточно для того, чтобы рекомендовать их рутинное использование для нормализации микрофлоры влагалища [23, 24].
Антимикробные свойства штамма пробиотических лактобацилл Lactobacillus rhamnosus Lcr35, который широко используется для восстановления нормальной микрофлоры влагалища и кишечника, описаны в ряде исследований [25–27]. Существует несколько промышленных препаратов данного штамма, один из которых препарат L. rhamnosus Lcr Regenerans, реализованный в коммерческом продукте Лактожиналь. При оценке их антимикробных свойств было показано, что способность препарата L. rhamnosus Lcr Regenerans продуцировать молочную кислоту в 6 раз превышает способность нативного штамма L. rhamnosus Lcr35 [28]. Кроме того, этот препарат показал повышенную способность in vitro ингибировать рост Gardnerella vaginalis. В проведенном нами ранее исследовании были выявлены конкурентные взаимоотношения дрожжеподобных грибов рода Candida и штамма лактобацилл, входящего в состав препарата Лактожиналь. Особенно это относится к C. albicans и C. glabrata [29]. Возможно, благодаря улучшенным антимикробным свойствам препарата Лактожиналь удалось добиться стойкой нормализации микрофлоры влагалища у женщины с нарушением микрофлоры влагалища после цервикального серкляжа.
Таким образом, результаты нашего исследования показали, что пробиотические лактобациллы могут с успехом использоваться для коррекции нарушений микробиоценоза влагалища, включая нарушения, ассоциированные с наложением шва на шейку матки.
About the authors
Natalia I Tapilskaya
St Petersburg State Pediatric Medical University
Author for correspondence.
Email: spb@gpma.ru
MD, Professor of the Department of Obstetrics and Gynecology Russian Federation
Alevtina M Savicheva
FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott”
Email: savitcheva@mail.ru
MD, Professor, Head of Laboratory of Microbiology Russian Federation
Elena V Shipitsyna
FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott”
Email: shipitsyna@inbox.ru
PhD, Senior Researcher, Laboratory of Microbiology Russian Federation
References
- Shennan A, Jones B. The cervix and prematurity: aetiology, prediction and prevention. Semin Fetal Neonatal Med. 2004;9:471-9. doi: 10.1016/j.siny.2004.09.001.
- Lee SE, Romero R, Park CW, et al. The frequency and significance of intraamniotic inflammation in patients with cervical insufficiency. Am J Obstet Gynecol. 2008;198:633e1-e8. doi: 10.1016/j.ajog.2007.11.047.
- Alfirevic Z, Stampalija T, Roberts D, Jorgensen AL. Cervical stitch (cerclage) for preventing preterm birth in singleton pregnancy. Cochrane Database Syst Rev. 2012;18;(4): CD008991. doi: 10.1002/14651858.CD008991.pub2.
- American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No.142: Cerclage for the management of cervical insufficiency. Obstet Gynecol. 2014;123(2 Pt 1):372-9. doi: 10.1097/01.AOG. 0000443276.68274.cc.
- Brown R, Gagnon R, Delisle MF, et al. Cervical insufficiency and cervical cerclage. J Obstet Gynaecol Can. 2013;35(12):1115-27.
- Petrova M, Lievens E, Malik S, et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health. Front Physiol. 2015;6:81. doi: 10.3389/fphys.2015.00081.
- Annells MF, Hart PH, Mullighan CG, et al. Interleukins-1, -4, -6, -10, tumor necrosis factor, transforming growth factor-beta, FAS, and mannose-binding protein C gene polymorphisms in Australian women: Risk of preterm birth. Am J Obstet Gynecol. 2004;191(6):2056-67.
- Abdel-Aleem H, Shaaban OM, Abdel-Aleem MA. Cervical pessary for preventing preterm birth. Cochrane Database Syst Rev. 2013;(5):CD007873. doi: 10.1002/14651858.CD007873.pub3.
- Romero R, Nicolaides KH, Conde-Agudelo A, et al. Vaginal progesterone decreases preterm birth ≤ 34 weeks of gestation in women with a singleton pregnancy and a short cervix: an updated meta-analysis including data from the OPPTIMUM study. Ultrasound Obstet Gynecol. 2016;48(3):308-17. doi: 10.1002/uog.15953.
- Di Renzo GC, Roura LC, Facchinetti F, et al. Guidelines for the management of spontaneous preterm labor: identification of spontaneous preterm labor, diagnosis of preterm premature rupture of membranes, and preventive toolsfor preterm birth. J Matern Fetal Neonatal Med. 2011;24(5):659-67. doi: 10.3109/14767058.2011.553694.
- Final report of the Medical Research Council/Royal College of Obstetricians and Gynaecologists multicentre randomised trial of cervical cerclage. MRC/RCOG Working Party on Cervical Cerclage. Br J Obstet Gynaecol. 1993;100:516-23.
- Melamed N, Ben-Haroush A, Chen R, et al. Intrapartum cervical lacerations: characteristics, risk factors, and effects on subsequent pregnancies. Am J Obstet Gynecol. 2009;200:388 e1-e4. doi: 10.1016/j.ajog.2008.10.034.
- Kindinger LM, MacIntyre DA, Lee YS, et al. Relationship between vaginal microbial dysbiosis, inflammation, and pregnancy outcomes in cervical cerclage. Sci Transl Med. 2016;8(350):350ra102. doi: 10.1126/scitranslmed.aag1026.
- Carey JC, Klebanov MA. Is a change in the vaginal flora associated with an increased risk of preterm birth? Am J Obstet Gynecol. 2005;192(4):1341–6. doi: 10.1016/j.ajog.2004.12.069.
- Donders GG, Van Calsteren K, Bellen G, et al. Predictive value for preterm birth of abnormal vaginal flora, bacterial vaginosis and aerobic vaginitis during the first trimester of pregnancy. BJOG: Int J Obstet Gynecol. 2009;116:1315-24. doi: 10.1111/j.1471-0528.2009.02237.x.
- Leitich H, Kiss H. Asymptomatic bacterial vaginosis and intermediate flora as risk factors for adverse pregnancy outcome. Best Pract Res Clin Obstet Gynaecol. 2007;21(3):375-90. doi: 10.1016/j.bpobgyn.2006.12.005.
- Keelan JA, Blumenstein M, Helliwel RJ. Cytokines, prostaglandins and parturition – a review. Placenta. 2003;24(SupplA):S33-46.
- Mancuso MS, Figueroa D, Szychowski JM, et al. Midtrimester bacterial vaginosis and cervical length in women at risk for preterm birth. Am J Obstet Gynecol. 2011;204:342. doi: 10.1016/j.ajog.2010.11.003.
- Stojanović N, Plećaš D, Plešinac S. Normal vaginal flora, disorders and application of probiotics in pregnancy. Arch Gynecol Obstet. 2012;286(2):325-32. doi: 10.1007/s00404-012-2293-7.
- McGregor JA, French JI, Jones W, et al. Bacterial vaginosis is associated with prematurity and vaginal fluid mucinase and sialidase: results of a controlled trial of topical clindamycin cream. Am J Obstet Gynecol. 1994;170:1048-1059.
- Kavak SB, Kavak E, Ilhan R, et al. The efficacy of ampicillin and Lactobacillus casei rhamnosus in the active management of pretermpremature rupture of membranes remote from term. Drug Des Devel Ther. 2014;8:1169-73. doi: 10.2147/DDDT.S68552.
- Krauss-Silva L, Moreira ME, Alves MB, et al A randomized controlled trial of probiotics for the prevention of spontaneous preterm delivery associated with bacterial vaginosis: preliminary results. Trials. 2011;12:239. doi: 10.1186/1745-6215-12-239.
- Othman M, Alfirevic Z, Neilson JP. Probiotics for preventing preterm labour. Cochrane Database Syst Rev. 2007; 24(1): CD005941. doi: 10.1002/14651858.cd005941.pub2.
- Reid JN, Bisanz JE, Monachese M, et al. The rationale for probiotics improving reproductive health and pregnancy outcome. Am J Reprod Immunol. 2013;69(6):558-66. doi: 10.1111/aji.12086.
- Petricevic L, Witt A. The role of Lactobacillus casei rhamnosus Lcr35 in restoring the normal vaginal flora after antibiotic treatment of bacterial vaginosis. BJOG. 2008;115(11):1369-74. doi: 10.1111/j.1471-0528.2008.01882.x.
- Coudeyras S, Jugie G, Vermerie M, Forestier C. Adhesion of human probiotic Lactobacillus rhamnosus to cervical and vaginal cells and interaction with vaginosis-associated pathogens. Infect Dis Obstet Gynecol. 2008:549640. doi: 10.1155/2008/549640.
- De Champs C, Maroncle N, Balestrino D, et al. 2003. Persistence of colonization of intestinal mucosa by a probiotics strain, Lactobacillus casei subsp. rhamnosus Lcr35, after oral consumption. J Clin Microbio. 2003;41(3):1270-73.
- Nivoliez A, Camares O, Paquet-Gachinat M, et al. Influence of manufacturing processes on in vitro properties of the probiotic strain Lactobacillus rhamnosus Lcr35®. J Biotechnol. 2012;160(3–4):236-41. doi: 10.1016/j.jbiotec.2012.04.005.
- Савичева А.М., Рыбина Е.В. Исследование in vitro роста, размножения, антибиотикорезистентности, конкурентных взаимоотношений штамма Lactobacillus casei rhamnosus // Акушерство и гинекология. – 2014. – № 7. – С. 79–83. [Savicheva AM, Rybina EV. Issledovanie in vitro rosta, razmnozheniya, antibiotikorezistentnosti, konkurentnyh vzaimootnoshenij shtamma Lactobacillus casei rhamnosus. Akusherstvo i ginekologiya. 2014;(7):79-83. (In Russ.)]
Supplementary files








