Proteomic Profile of Tears for the Diagnosis of Uveitis Associated with Juvenile Idiopathic Arthritis: Setting Targets to Achieve Results
- Authors: Chasnyk V.G1, Gaidar E.V1, Kononov A.V.2, Ammosova T.3, Hynes A.4, Dubko M.F1, Kostik M.M1, Nikitina T.N1, Serogodskaia E.D1, Kalashnikova O.V1, Masalova V.V1, Snegireva L.S1, Keltsev V.A5, Grebenkina L.I5, Obukhov Y.3, Lin X.3, Nekhai S.3
-
Affiliations:
- St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
- North-Western State Medical University named after I.I. Mechnikov
- Howard University
- Eye Care Physicians and Surgeons
- Togliatti Municipal Clinical Hospital No 5
- Issue: Vol 8, No 1 (2017)
- Pages: 5-26
- Section: Articles
- URL: https://journals.eco-vector.com/pediatr/article/view/6111
- DOI: https://doi.org/10.17816/PED815-26
- ID: 6111
Cite item
Full Text
Abstract
The paper presents epidemiologic and pathophysiological aspects of the problem statement for early recognition of Uveitis (Uv) associated with Juvenile Idiopathic Arthritis (JIA) in terms of the proteomic profile of tears as well as the results of an attempt to solve this problem by means of the Tandem Mass-Spectrometry (TMS). The solution of this problem is of the highest relevance due to revolutionary changes in treatment strategies after introducing highly effective biologics. Content analysis of literature reviews reveals the following: 1. the incidence of JIA-Uv in the Northwest Federal District of Russian Federation averages 0.5-0.7 per 100 000 of children with the prevalence being ten-fold higher than incidence, 2. without Methotrexate treatment 4-7 years after the diagnosis of JIA-Uv cataract is revealed in 35-40% of children and in 5% – glaucoma as well, 3. even with Methotrexate in 28-40% of children the complications of JIA-Uv inevitably will be revealed with blurred vision in 10-36% of children, 4. timely diagnosis of JIA-Uv and adequate treatment reduce the risk of complications by 4% per year, 5. current medical care system reveals in one third of children already the complications of JIA-Uv. Revelation in tears of the motif mode for protein interaction network, triggering mobilization/inhibition of cells which moderate Uv would contradict the traditional point of view on existing natural anatomic and physiologic barriers, isolating the intraocular space, but however seems to be possible since JIA is a systemic disease and Uv leads to damage of the blood-retinal barriers. To reveal protein biomarkers of JIA-Uv tears of 31 children aged 2-17 years were studied: 17 – chronic JIA-Uv, 4 – JIA without Uv, 4 – idiopathic Uv, 3 – systemic vasculitis, 3 – healthy children. We used the current clinical guidelines and standards to diagnose the pathology and TMS with hierarchical clustering methodology for protein identification: nano C18 column attached to Shimadzu nano LC coupled in-line to LTQ Orbitrap XL tandem mass spectrometer, data-dependent 4-event scan method, a survey FT-MS parent scan followed by sequential data dependent FT-MS/MS scans on the three most abundant peptide ions. Proteins were identified from the mass spectra results with Proteome Discoverer 1.2 software for protein database search using the International Protein Index (IPI) and Human Protein Database. Quantification was conducted using SIEVE 2.0 after normalization to albumin keeping in mind the validity of proportional change of its concentration after stimulation of lacri-mation. Data from SIEVE were exported to IPA (Ingenuity Pathway Analysis) for filtering. The extracellular proteins selected in Ingenuity were further analyzed for disease relation and networks formation. TMS revealed more than 3000 proteins in tears and 300 of them have been considered to be the first row candidates to be biomarkers of JIA-Uv. The top two proteins, lactoferrin and lipocalin were upregulated over ten-fold in children with Uv. Pathway analysis placed these proteins into the inflammation-related IL-1 and TNF-α related networks which also included proteins involved in the development of endothelial dysfunction, inflammation and retinopathy. In addition, IL-23, which was previously linked to Uveitis, was found to be upregulated. Taken together, our proof-of-principle study presents a novel and yet untested approach for detection of early biomarkers of Uveitis and identified several candidate proteins.
Full Text
Эпидемиологические основы исследования
Как известно, увеит, т. е. воспаление увеальных (сосудистых) компонентов глаза - радужки, сосудистой оболочки и сетчатки, распространен в детской популяции не очень широко. В год в среднем выявляется 4,3–6,9 новых случая увеита на 100 000 населения при общей распространенности около 30 случаев на 100 000 [23, 54, 70]. До 6 % всех увеитов у взрослых начинаются в детстве [67]. Диагностика и лечение увеита у детей, составляющих всего 5 % от всей численности страдающих увеитом в популяции [70], представляют большую проблему, поскольку течение заболевания часто маломанифестно [9], дети, как правило, не жалуются на ухудшение зрения и настроены негативно по отношению к активному офтальмологическому осмотру. В результате до 30–40 % детей, страдающих увеитом, в значительной степени теряют зрение [4, 107]. Слепота, по крайней мере односторонняя, наступает у 17–35 % детей, а ухудшение зрения ниже 20/40 — у 17–41 % детей [23, 79].
Причины увеита у детей, как и у взрослых, чрезвычайно разнообразны, причем неинфекционные увеиты являются наиболее частой формой, а в 60 % случаев причина заболевания вообще остается нераспознанной [9, 23, 54, 70, 79, 94].
Увеит классифицируют в соответствии со стандартами, определенными номенклатурой SUN (Standardization of Uveitis Nomenclature) [22, 42], предполагающей учет времени протекания патологического процесса и вовлеченных в него структур глаза (рис. 1) [40].

Рис. 1. Схематическое изображение глаза с указанием структур, поражаемых при переднем, среднем и заднем увеите. В скобках приведены симптомы поражения
В табл. 1 представлены критерии увеита согласно протоколу SUN [42].
Таблица 1. Классификация степеней увеита и критерии обострения согласно протоколу SUN
Протокол SUN: степени увеита по количеству клеток в передней камере (для поля зрения щелевой лампы 1 мм2) | |
Степень | Количество клеток в поле зрения |
0 | < 1 |
0,5+ | 1–5 |
1+ | 6–15 |
2+ | 16–25 |
3+ | 26–50 |
4+ | 50+ |
Протокол SUN: критерии обострения увеита по визуально наблюдаемому накоплению плазменных белков | |
Степень | Описание |
0 | Нет обострения |
1+ | Легкое |
2+ | Умеренное (радужка/хрусталик чисты) |
3+ | Выраженное (радужка/хрусталик замутнены) |
4+ | Сильное (коагуляция фибрино/серозно-пластическая) |
Увеит может быть острым, подострым, хроническим и рецидивирующим. В патологический процесс вовлекаются все отделы глаза (см. рис. 1), но с разной частотой: передний увеит — в 30–90 % случаев [54, 94], средний — в 25–42 % случаев [42, 54, 94], задний встречается редко и, как и у взрослых, в большинстве случаев обусловлен инфицированием токсоплазмой [23, 70]. Еще реже заболевание поражает все оболочки глаза (панувеит).
Из-за задержек с диагностикой ребенок часто поступает на первый осмотр окулиста уже со снижением зрения вследствие наличия осложнений увеита, в числе которых наиболее частыми являются катаракта (35–52 %), отек зрительного нерва (17–29 %), рубцы макулы (27 %), вторичная глаукома (15–33 %), неврит зрительного нерва (8 %), отслойка сетчатки (8 %) [4, 9, 39, 54, 79, 107], причем общеизвестно, что увеит, ассоциированный с ювенильным идиопатическим артритом, является наиболее частой причиной этих осложнений [54], вероятность возникновения которых при этой форме заболевания составляет до 34 % в течение последующих за постановкой диагноза 5–6 лет наблюдения [11].
Увеит — одно из наиболее частых экстраартикулярных проявлений ювенильного идиопатического (ревматоидного) артрита (ЮИА), представляющего собой достаточно гетерогенную группу хронических артритов детского возраста [34], из которых в части, имеющей отношение к увеиту, особое значение приобретает олигоартикулярная форма (поражение четырех или менее суставов в течение первых 6 месяцев заболевания).
Частота выявления новых случаев ЮИА в США и Канаде составляет 0,041–0,061 на 1000 детей при доле олигоартикулярной формы в группе детей с ЮИА в США, как и в Европе, 30–60 % [59]. В некоторых этнических группах (индейцы, коренные жители Азии и Австралии) эти значения могут быть на порядок больше [61, 63].
Данные о распространенности увеита, ассоциированного с ЮИА, весьма вариабельны: от 11,6 [5] до 30 % [66] всех детей с ЮИА, или у 30 % всех детей с ЮИА, имеющих антинуклеарные антитела [75].
Исследование большой группы детей с ЮИА, проведенное в Германии, выявило наличие увеита у 12 % больных в целом и у 16–25 % детей с олигоартикулярной формой артрита [34].
Широта диапазона вариации распространенности отчасти обусловлена наличием четырех известных управляющих групп факторов, часть из которых ассоциирована с генетическими особенностями популяций [64].
Большинство специалистов считают, что, кроме олигоартикулярной формы артрита, еще как минимум три фактора определяют большую вероятность возникновения увеита: женский пол, возраст дебюта артрита младше 6 лет, а также наличие антинуклеарных антител в крови [14, 35, 74].
В частности, в возрастной группе 1–2 года увеит был выявлен у 37 % девочек и только у 7 % мальчиков [82]. Такое же соотношение частоты увеита было обнаружено для той же возрастной группы у больных ЮИА с наличием антинуклеарных антител (47 против 10 % соответственно). Вместе с тем при манифестации артрита в возрасте позже 7 лет вероятность выявления увеита у девочек была меньше 10 %, а мужской пол более тесно ассоциировался с катарактой, макулярным отеком и папиллитом, возникающими в течение последующих 5 лет наблюдения [48], мужской пол определял более чем шестикратное увеличение вероятности слепоты [49].
Таким образом, пол, возраст дебюта артрита, наличие антинуклеарных антител не могут считаться общепринятыми неблагоприятными маркерами, особенно в том, что касается оценки независимости влияния каждого из этих факторов [13, 76, 82, 86].
Наиболее частой формой увеита, ассоциированного с ЮИА, является хронический передний увеит, который может быть уни- или билатеральным (доля последнего — 70 %). Доля переднего увеита достигает 83 %, средний, задний увеиты и панувеит встречаются значительно реже (9, 1, 7 % соответственно) [34].
В 68 % всех случаев течение увеита — хроническое, в 16 % случаев — острое и в 12 % случаев — рецидивирующее [81].
Острый передний увеит у больных ЮИА встречается обычно при энтезит- или HLA B27-ассоциированном артрите.
Среднее время от появления суставного синдрома до регистрации первых признаков возникновения увеита составляет 1,8 года, причем чем короче этот интервал, тем более тяжелым по течению является увеит и тем больше вероятность осложнений [104]. Иногда увеит возникает еще до клинических признаков поражения суставов, и длительность этого лага может достигать нескольких лет [38, 94]. Количество таких случаев доходит до 3–7 % детей с ЮИА, а сам факт появления увеита до артрита является признаком неблагоприятного течения увеита [34, 35].
Результаты ретроспективных исследований течения увеита, ассоциированного с ЮИА (см. обзор Sen E.S. et al., 2015), показывают, что в целом у 28–67 % детей возникают осложнения [6, 84, 102], а у 9,2–36 % детей высока вероятность существенного ухудшения зрения (< 20/40 оба глаза) [6, 14, 102] из-за формирования катаракты (20,5 %), глаукомы (18,9 %) и лентовидной кератопатии (15,7 %).
Длительное мониторирование в семидесятые — восьмидесятые годы прошлого века (эпоха до введения метотрексата в лечение ЮИА) состояния детей с увеитом, ассоциированным с ЮИА [52, 87], позволило установить: через 7 лет у 42 % детей сформировалась катаракта, у 5 % — глаукома. К взрослому возрасту у половины пациентов формируется катаракта, у 22 % — глаукома и около 50 % имеют признаки активного увеита или получают местно кортикостероиды для купирования его обострения.
Надо признать, что в последние годы в связи с широким внедрением новых программ диагностики и иммуносупрессивной терапии частота осложнений постепенно уменьшается [53, 91]. Так, сравнение течения заболевания у 239 детей с ЮИА-ассоциированным увеитом, леченных в 1990–1993 гг., с таковым у 240 детей, леченных в 2000–2003 гг., приводит к выводу о существенном снижении частоты осложнений — с 35 до 21 % соответственно. До 91 % глаз удается сохранить, хотя и с падением остроты зрения. Около 6 % глаз полностью теряют способность видеть [11]. Вместе с тем частота обнаружения тяжелого увеита в момент постановки диагноза с 1993 г., когда были впервые предложены стандарты офтальмологического скрининга для детей, страдающих ЮИА, не уменьшилась [16].
Увеит, начавшийся у детей в раннем возрасте, может иметь двухфазное течение: снижение активности в возрасте около 9 лет с последующей активацией патологического процесса в пубертатном возрасте [37].
Среди факторов риска тяжелого течения увеита и развития осложнений, кроме раннего дебюта и короткого лага между появлением артрита и увеита, можно отметить мужской пол и наличие синехий при первом офтальмологическом осмотре [5, 16, 23, 46].
Ретроспективный анализ течения увеита, ассоциированного с ЮИА, у 327 пациентов позволил выявить общую частоту потери зрения до 20/50 или меньше, равную 0,18 случая/глаза × год, общую частоту развития новых осложнений — 0,15 случая/глаза × год. Для случаев, когда диагноз увеита был поставлен еще до появления осложнений, частота развития новых осложнений была существенно меньше — 0,04 случая/глаза × год. При этом наличие двустороннего поражения, длительное течение увеита, наличие задних синехий, низкое (< 5 мм рт. ст.) или высокое (> 21 мм рт. ст.) внутриглазное давление, активный увеит (степень ≥ 1 по количеству клеток в передней камере или ≥ 0,5 по мутности стекловидного тела), офтальмологические операции в анамнезе являются факторами неблагоприятного прогноза [31].
Риск формирования катаракты у детей с хроническим передним увеитом в течение четырех лет, рассчитанный Thorne [103], соответствует формуле 0,04/глаз × год. При этом существенными неблагоприятными факторами являлись задние синехии, активный увеит и использование локально кортикостероидов. Вероятность катаракты была равна 0 при использовании двух или менее капель кортикостероидов, но возрастала до 0,16/глаз × год при использовании трех и более капель в сутки.
Патофизиологические основы исследования
Общепринятым является мнение о том, что ЮИА является заболеванием, сопряженным с нарушением Т-клеточного звена иммунитета. Дисрегуляция цитокинов, в первую очередь фактора некроза опухолей — альфа (TNF-α), лежит в основе как олиго-, так и полиартикулярного артрита и увеита при генетическом детерминировании [45, 101] и предположительном (но недоказанном) участии внешних факторов [59].
Традиционно предполагается, что неинфекционные увеиты по своей природе являются аутоиммунными заболеваниями, возникающими вследствие потери иммунной толерантности к аутоантигенам и последующей активации аутореактивных T-лимфоцитов [15, 55, 57, 68, 96]. Эта точка зрения сформировалась в результате анализа исследований, проведенных на экспериментальных моделях аутоиммунного увеита, ассоциированного с энцефалитом, а также вызванного введением эндотоксина, меланина [64].
Механизмы формирования увеита, ассоциированного с ювенильным идиопатическим артритом, не вполне ясны. Современные представления о его патогенезе схематически представлены на рис. 2 [15]. Неинфекционный увеит считается обусловленным вовлечением в патологический процесс Т-клеточного звена иммунитета с участием CD4+ T-хелперных клеток типов 1 и 17, продуцирующих соответственно интерферон-гамма и интерлейкин-17 [15, 57, 68].
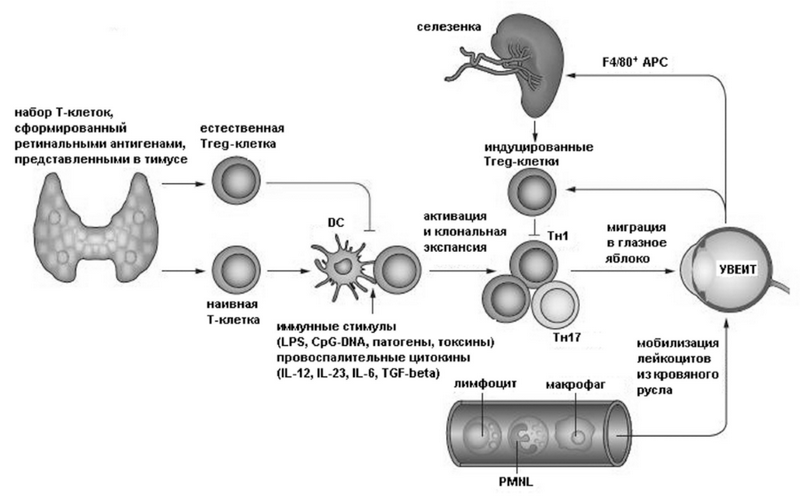
Рис. 2. Клеточные механизмы увеита: APC — антигенпрезентирующая клетка, DC — дендритная клетка, LPS — липополисахарид, PMNL — полиморфноядерный лимфоцит, Tн — Т-хелпер, Treg-клетка — Т-регуляторная клетка, CpG-DNA — цитозин-фосфат-гуанин динуклеотид
Активность этих провоспалительных T-клеток управляется CD4+, CD25+, FoxP3+, T-регуляторными клетками, в том числе и индуцируемыми. Патогенетическая роль как Т-хелперных клеток 1-го и 17-го типов, так и регуляторных Т-клеток при неинфекционном увеите установлена в ходе экспериметальных и клинических исследований, однако детальные механизмы участия каждого из этих звеньев в формировании заболевания неизвестны [2, 47, 71, 80].
Неполная элиминация в тимусе эффекторных прекурсоров Т-клеток, ответственных за распознавание ретинальных антигенов, приводит к существованию циркулирующих нетолеризованных Т-клеток. Эти клетки активируются антигенами или кроссреактивными ан
About the authors
Vyacheslav G Chasnyk
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Author for correspondence.
Email: chasnyk@gmail.com
MD, PhD, Dr Med Sci, Professor, Head of the Department of Hospital Pediatrics Russian Federation
Ekaterina V Gaidar
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Email: gaidare85@gmail.com
MD, Research Fellow, Chair of Hospital Pediatrics Russian Federation
Anatolii Viktorovich Kononov
North-Western State Medical University named after I.I. Mechnikov
Email: 7435020@gmail.com
MD, Research Fellow, Chair of ophthalmology Russian Federation
Tatyana Ammosova
Howard University
Email: t.ammosova@gmail.com
PhD, Assistant Professor, Department of Medicine Russian Federation
Alla Hynes
Eye Care Physicians and Surgeons
Email: rozalat@hotmail.com
MD, Ophthalmologist, Director Russian Federation
Margarita F Dubko
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Email: andrq@rambler.ru
MD, PhD, Associate Professor, Chair of Hospital Pediatrics Russian Federation
Mikhail M Kostik
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Email: kost-mikhail@yandex.ru
MD, PhD, Associate Professor, Chair of Hospital Pediatrics Russian Federation
Tatiana N Nikitina
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Email: chasnyk@gmail.com
MD, PhD, Assistant Professor, Chair of Ophthalmology Russian Federation
Elena D Serogodskaia
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Email: chasnyk@gmail.com
MD, PhD, Assistant Professor, Chair of Ophthalmology Russian Federation
Olga V Kalashnikova
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Email: koira7@yandex.ru
MD, PhD, Associate Professor, Chair of Hospital Pediatrics Russian Federation
Vera V Masalova
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Email: masalova.vera@gmail.com
MD, PhD, Associate Professor, Chair of Hospital Pediatrics Russian Federation
Ludmila S Snegireva
St Petersburg State Pediatric Medical University, Ministry of Healthcare of the Russian Federation
Email: l.s.snegireva@mail.ru
MD, Department of Pediatrics No 3 Russian Federation
Vladimir A Keltsev
Togliatti Municipal Clinical Hospital No 5
Email: keltsev@mail.ru
MD, PhD, Consulting professor Russian Federation
Liudmila I Grebenkina
Togliatti Municipal Clinical Hospital No 5
Email: keltsev@mail.ru
MD, PhD, Pediatric cardiologist Russian Federation
Yuri Obukhov
Howard University
Email: yuobukhov@hotmail.com
PhD, Research Scientist Russian Federation
Xionghao Lin
Howard University
Email: xionghao.lin@howard.edu
PhD, Research Scientist Russian Federation
Sergei Nekhai
Howard University
Email: snekhai@howard.edu
PhD, Professor, Department of Medicine Russian Federation
References
- Agarwal S, Agarwal A, Apple DJ, et al. Textbook of Ophthalmology. New Delhi: Jaypee Brothers Medical Publishers (P) Ltd.; 2002. 657 p.
- Amadi-Obi A, et al. TH17 cells contribute to uveitis and scleritis and are expanded by IL 2 and inhibited by IL 27/STAT1. Nat Med. 2007;13:711-718. doi: 10.1038/nm1585.
- Ananthi S, Santhosh RS, Nila MV, et al. Comparative proteomics of human male and female tears by two-dimensional electrophoresis. Exp Eye Res. 2011;92:454-63. doi: 10.1016/j.exer.2011.03.002.
- Anesi SD, Foster CS. Importance of Recognizing and Preventing Blindness From Juvenile Idiopathic Arthritis – Associated Uveitis. Arthritis Care Res (Hoboken). 2012;5:653-657. doi: 10.1002/acr.21599.
- Angeles-Han ST, Yeh S, Vogler LB. Updates on the risk markers and outcomes of severe juvenile idiopathic arthritis-associated uveitis. Int J Clin Rheumatol. 2013;8:109-121. doi: 10.2217/ijr.12.83.
- Asproudis I, Felekis T, Tsanou E, et al. Juvenile idiopathic arthritis-associated uveitis: Data from a region in western Greece. Clin Ophthalmol. 2010;4:343-7.
- Baker E, Baker H. Lactoferrin. Cell Mol Life Sci. 2005;62:2531-2539. doi: 10.1007/s00018-005-5368-9.
- Baynes RD, Bezwoda WR. Lactoferrin and the inflammatory response. Adv Exp Med Biol. 1994;357:133-141. doi: 10.1007/978-1-4615-2548-6_13.
- Ben Ezra D, Cohen E, Maftzir G. Uveitis in children and adolescents. Br J Ophthalmol. 2005;89:444-8. doi: 10.1136/bjo.2004.050609.
- Beukelman T, Patkar NM, Saag KG, Tolleson-Rinehart S, et al. American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: Initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features. Arthritis Care Res (Hoboken). 2011;63(4):465-82. doi: 10.1002/acr.20460.
- Bolt IB, Cannizzaro E, Sege R, Saurenmann RK. Risk factors and longterm outcome of juvenile idiopathic arthritis-associated uveitis in Switzerland. J Rheumatol. 2008;35:703-706.
- Caccavo D, Garzia P, Sebastiani GD, Ferri GM, et al. Expression of lactoferrin on neutrophil granulocytes from synovial fluid and peripheral blood of patients with rheumatoid arthritis. J Rheumatol. 2003;30:220-224.
- Calandra S, et al. Female sex and oligoarthritis category are not risk factors for uveitis in Italian children with juvenile idiopathic arthritis. J Rheumatol. 2014;41:1416-1425. doi: 10.3899/jrheum.131494.
- Carvounis PE, Herman DC, Cha S, Burke JP. Incidence and outcomes of uveitis in juvenile rheumatoid arthritis, a synthesis of the literature. Graefes Arch Clin Exp Ophthalmol. 2006;244:281-290. doi: 10.1007/s00417-005-0087-3.
- Caspi RR. A look at autoimmunity and inflammation in the eye. J Clin Invest. 2010;120:3073-3083. doi: 10.1172/JCI42440.
- Chia A, Lee V, Graham EM, Edelsten C. Factors related to severe uveitis at diagnosis in children with juvenile idiopathic arthritis in a screening programme. Am J Ophthalmol. 2003;135:757-762. doi: 10.1016/S0002-9394(03)00225-3.
- McClellan K. Mucosal defense of the outer eye. Surv Ophthalmol. 1997;42:233-246. doi: 10.1016/S0039-6257(97)00090-8.
- Coyle PK, Sibony PA, Johnson C. Electrophoresis combined with immunologic identification of human tear proteins. Invest Ophthalmol Vis Sci. 1989;30:1872-8.
- Cumberbatch M, Bhushan M, Dearman RJ. IL-1beta-induced langerhans’ cell migration and tnf-alpha production in human skin: Regulation by lactoferrin. Clin Exp Immunol. 2003;132:352-359. doi: 10.1046/j.1365-2249.2003.02146.x.
- Damiens E, Mazurier J, El Yazidi I, et al. Effects of human lactoferrin on nk cell cytotoxicity against haematopoietic and epithelial tumour cells. BBA-Mol. Cell Res. 1998;1402:277-287.
- Dashper SG, Pan Y, Veith PD, et al. Lactoferrin inhibits porphyromonas gingivalis proteinases and has sustained biofilm inhibitory activity. Antimicrob Agents Chemother. 2012;56:1548-1556. doi: 10.1128/AAC.05100-11.
- Deschenes J, Murray PI, Rao NA, Nussenblatt RB. & International Uveitis Study Group. International Uveitis Study Group (IUSG): clinical classification of uveitis. Ocul Immunol Inflamm. 2008;16:1-2. doi: 10.1080/09273940801899822.
- Edelsten C, Reddy MA, Stanford MR, Graham EM. Visual loss associated with pediatric uveitis in English primary and referral centers. Am J Ophthalmol 2003;135:676-80. doi: 10.1016/S0002-9394(02)02148-7.
- Farnaud S, Evans RW. Lactoferrin-A multifunctional protein with antimicrobial properties. Mol Immunol. 2003;40:395-405. doi: 10.1016/S0161-5890(03)00152-4.
- Gachon AM, Verrelle P, Betail G, Dastugue B. Immunological and electrophoretic studies of human tear proteins. Exp Eye Res. 1979;29:539-553. doi: 10.1016/0014-4835(79)90154-4.
- Gahr M, Speer C, Damerau B, Sawatzki G. Influence of lactoferrin on the function of human polymorphonuclear leukocytes and monocytes. J Leukoc Biol. 1991;49:427-433.
- McGeachy MJ, Bak-Jensen KS, Chen Y, et al. TGF-[beta] and IL-6 drive the production of IL-17 and IL-10 by T cells and restrain TH-17 cell-mediated pathology. Nat Immunol. 2007;8(12):1390-7.
- González-Chávez SA, Arévalo-Gallegos S, Rascón-Cruz Q. Lactoferrin: Structure, function and applications. Int J Antimicrob Agents. 2009;33:32-8. doi: 10.1016/j.ijantimicag.2008.07.020.
- Green-Church KB, Butovich I, Willcox M. The International Workshop on Meibomian Gland Dysfunction: Report of the Subcommittee on Tear Film Lipids and Lipid — Protein Interactions in Health and Disease. Investigative Ophthalmology & Visual Science. 2011;52(4):1979-1993. doi: 10.1167/iovs.10-6997d.
- Green-Church KB, Nichols KK, Kleinholz NM, et al. Investigation of the human tear film proteome using multiple proteomic approaches. Mol Vis. 2008;14:456-70.
- Gregory AC, et al. Risk factors for loss of visual acuity among patients with uveitis associated with juvenile idiopathic arthritis: the Systemic Immunosuppressive Therapy for Eye Diseases study. Ophthalmology. 2013;120:186-192. doi: 10.1016/j.ophtha.2012.07.052.
- Grus FH, Podust VN, Bruns K, et al. SELDI-TOF-MS ProteinChip array profiling of tears from patients with dry eye. Invest Ophthalmol Vis Sci. 2005;46:863-76. doi: 10.1167/iovs.04-0448.
- van Haeringen NJ. Aging and the lacrimal system. Br J Ophthalmol. 1997;81:824-826. doi: 10.1136/bjo.81.10.824.
- Heiligenhaus A, et al. Prevalence and complications of uveitis in juvenile idiopathic arthritis in a population-based nation-wide study in Germany: suggested modification of the current screening guidelines. Rheumatology (Oxford). 2007;46:1015-1019. doi: 10.1093/rheumatology/kem053.
- Heiligenhaus A, Heinz C, Edelsten C, et al. Review for disease of the year: epidemiology of juvenile idiopathic arthritis and its associated uveitis: the probable risk factors. Ocul Immunol Inflamm. 2013;21:180-191. doi: 10.3109/09273948.2013.791701.
- Heiligenhaus A, Niewerth M, Ganser G, et al. Prevalence and complications of uveitis in juvenile idiopathic arthritis in a population-based nation-wide study in Germany: suggested modification of the current screening guidelines. Rheumatology (Oxford). 2007;46(6):1015-9. doi: 10.1093/rheumatology/kem053.
- Hoeve M, Kalinina Ayuso V, Schalij-Delfos NE, et al. The clinical course of juvenile idiopathic arthritis-associated uveitis in childhood and puberty. Br J Ophthalmol. 2012;96(6):852-856. doi: 10.1136/bjophthalmol-2011-301023.
- Holland GN, Denove CS, Yu F. Chronic anterior uveitis in children: clinical characteristics and complications. Am J Ophthalmol. 2009;147:667-78. doi: 10.1016/j.ajo.2008.11.009.
- Holland GN, Stiehm ER. Special considerations in the evaluation and management of uveitis in children. Am J Ophthalmol. 2003;135:867-78. doi: 10.1016/S0002-9394(03)00314-3.
- 40.Hughes EH, Dick AD. The pathology and pathogenesis of retinal vasculitis. Neuropathol. Appl Neurobiol. 2003;29:325-340. doi.org/10.1046/j.1365-2990.2003.00499.x.
- Iigo M, Alexander DB, Long N, et al. Anticarcinogenesis pathways activated by bovine lactoferrin in the murine small intestine. Biochimie. 2009;91:86-101. doi: 10.1016/j.biochi.2008.06.012.
- Jabs DA, Nussenblatt RB, Rosenbaum JT. Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am J Ophthalmol. 2005;140:509-16. doi: 10.1016/j.ajo.2005.03.057.
- Jacob JT, Ham B. Compositional profiling and biomarker identification of the tear film. Ocul Surf. 2008;6:175-85. doi: 10.1016/S1542-0124(12)70178-7.
- Jones LT, Reeh MJ, Wirtschafter JD. Manual of Ophthalmic Anatomy. Rochester, MN: American Academy of Ophthalmology and Otolaryngology; 1970. 597 p.
- Julián K, Terrada C, Quartier P, et al. Uveitis related to juvenile idiopathic arthritis: familial cases and possible genetic implication in the pathogenesis. Ocul Immunol Inflamm. 2010;18:172-177.45.
- Kalinina Ayuso V, Ten Cate HA, van der Does P, et al. Male Gender as a Risk Factor for Complications in Uveitis Associated with Juvenile Idiopathic Arthritis. Am J Ophthalmol. 2010;149(6):994-9. doi: 10.1016/j.ajo.2010.01.016.
- Kalinina Ayuso V, et al. Pathogenesis of juvenile idiopathic arthritis associated uveitis: the known and unknown. Surv Ophthalmol. 2014;59:517-531. doi: 10.1016/j.survophthal.2014.03.002.
- Kalinina Ayuso V, Ten Cate HA, van der Does P, et al. Male gender and poor visual outcome in uveitis associated with juvenile idiopathic arthritis. Am J Ophthalmol. 2010;149:987-93. doi: 10.1016/j.ajo.2010.01.014.
- Kalinina Ayuso V. Uveitis in childhood. Clinical and fundamental developments. Thesis. Utrecht: University Medical Centre; 2013. P. 259.
- Kanwar JR, Mahidhara G, Roy K, et al. Fe-blf nanoformulation targets survivin to kill colon cancer stem cells and maintains absorption of iron, calcium and zinc. Nanomedicine. 2014;10:35-55. doi: 10.2217/nnm.14.132.
- Kanwar JR, Roy K, Patel Y, Zhou SF, et al. Multifunctional Iron Bound Lactoferrin and Nanomedicinal Approaches to Enhance Its Bioactive Functions. Molecules. 2015;20:9703-9731. doi: 10.3390/molecules20069703.
- Kotaniemi K, Arkela-Kautiainen M, Haapasaari J, Leirisalo-Repo M. Uveitis in young adults with juvenile idiopathic arthritis: a clinical evaluation of 123 patients. Ann Rheum Dis. 2005;64:871-874. doi: 10.1136/ard.2004.026955.
- Kotaniemi K, et al. The frequency and outcome of uveitis in patients with newly diagnosed juvenile idiopathic arthritis in two 4 year cohorts from 1990-1993 and 2000-2003. Clin Exp Rheumatol. 2014;32:143-147.
- Kump LI, Cervantes-Castaneda RA, Androudi SN, Foster CS. Analysis of pediatric uveitis cases at a tertiary referral center. Ophthalmology. 2005;112:1287-92. doi: 10.1016/j.ophtha.2005.01.044.
- Lee RW, Dick AD. Current concepts and future directions in the pathogenesis and treatment of noninfectious intraocular inflammation. Eye (Lond). 2012;26:17-28. doi: 10.1038/eye.2011.255.
- Legrand D, Elass E, Carpentier M, Mazurier J. Lactoferrin: A modulator of immune and inflammatory responses. Cell Mol Life Sci. 2005;62:2549-2559. doi: 10.1007/s00018-005-5370-2.
- Levy RA, de Andrade FA, Foeldvari I. Cutting-edge issues in autoimmune uveitis. Clin Rev Allergy Immunol. 2011;41:214-223. 75.
- Li N, Wang N, Zheng J, et al. Characterization of human tear proteome using multiple proteomic analysis techniques. J Proteome Res. 2005;4:2052-61. doi: 10.1021/pr0501970.
- Macaubas C, Nguyen K, Milojevic D, et al. Oligoarticular and polyarticular JIA: epidemiology and pathogenesis. Nat Rev Rheumatol. 2009;5(11):616-26.105.
- Machnicki M, Zimecki M, Zagulski T. Lactoferrin regulates the release of tumour necrosis factor alpha and interleukin 6 in vivo. Int J Exp Pathol. 1993;74:433-439.
- Manners PJ, Diepeveen D. Prevalence of juvenile chronic arthritis in a population of 12 year old children in urban Australia. Pediatrics. 1996;98:84-90.
- Mathers WD, Lane JA, Zimmerman MB. Tear film changes associated with normal aging. Cornea. 1996;15:229-34. doi: 10.1097/00003226-199605000-00001.
- Mauldin J, Dan Cameron H, Jeanotte D, et al. Chronic arthritis in children and adolescents in two Indian health service user populations. BMC Musculoskeletal Disorders 2004;5:30. doi: 10.1186/1471-2474-5-30.
- Menezo V. The Genetic Predictors of Severe Outcome in Patients with Anterior Uveitis. Thesis. London: Institute of Ophthalmology, University College; 2011. P. 238.
- Mii S, Nakamura K, Takeo K, Kurimoto S. Analysis of human tear proteins by two-dimensional electrophoresis. Electrophoresis. 1992;13:379-82. doi: 10.1002/elps.1150130177.
- Moradi A, Amin RM, Thorne JE. The role of gender in juvenile idiopathic arthritis-associated uveitis. J Ophthalmol. 2014;4:610-78. doi: 10.1155/2014/461078.
- Nguyen QD, Foster CS. Saving the vision of children with juvenile rheumatoid arthritis-associated uveitis. JAMA. 1998;280(13):1133-4. doi: 10.1001/jama.280.13.1133.
- Nussenblatt RB, Gery I. Experimental autoimmune uveitis and its relationship to clinical ocular inflammatory disease. J Autoimmun. 1996;9:575-585. doi: 10.1006/jaut.1996.0077.
- Ohashi Y, Dogru M, Tsubota K. Laboratory findings in tear fluid analysis. Clin Chim Acta. 2006;369:17-28. doi: 10.1016/j.cca.2005.12.035.
- Paivonsalo-Hietanen T, Tuominen J, Saari KM. Uveitis in children: population-based study in Finland. Acta Ophthalmol Scand. 2000;78:84-8. doi: 10.1034/j.1600-0420.2000.078001084.x.
- Parikh JG, Tawansy KA, Rao NA. Immunohistochemical study of chronic nongranulomatous anterior uveitis in juvenile idiopathic arthritis. Ophthalmology. 2008;115:1833-1836. doi: 10.1016/j.ophtha.2008.03.027.
- Parhi P, Mohanty C, Sahoo SK. Nanotechnology-based combinational drug delivery: An emerging approach for cancer therapy. Drug Discov Today. 2012;17-18, 1044-1052. doi: 10.1016/j.drudis.2012.05.010.
- Puddu P, Valenti P, Gessani S. Immunomodulatory effects of lactoferrin on antigen presenting cells. Biochimie. 2009;91:11-18. doi: 10.1016/j.biochi.2008.05.005.
- Qian Y, Acharya NR. Juvenile idiopathic arthritis-associated uveitis. Curr Opin Ophthalmol. 2010;21:468-472. doi: 10.1097/ICU.0b013e32833eab83.
- Ravelli A, Felici E, Magni-Manzoni S, et al. Patients with antinuclear antibody-positive juvenile idiopathic arthritis constitute a homogeneous subgroup irrespective of the course of joint disease. Arthritis Rheum. 2005;52(3):826-32. doi: 10.1002/art.20945.
- Reininga JK, Los LI, Wulffraat NM, Armbrust W. The evaluation of uveitis in juvenile idiopathic arthritis (JIA) patients: are current ophthalmologic screening guidelines adequate? Clin Exp Rheumatol. 2008;26:367-372.
- Reitamo S, Konttinen Y, Segerberg-Konttinen M. Distribution of lactoferrin in human salivary glands. Histochemistry. 1980;66:285-291. doi: 10.1007/BF00495741.
- Roque MR, Foster CS, Miserocchi E, Roque BL, et al. Juvenile Idiopathic Arthritis Uveitis. 06 January, 2016. 30/11/2016: [http://emedicine.medscape.com/article/1209891].
- Rosenberg KD, Feuer WJ, Davis JL. Ocular complications of pediatric uveitis. Ophthalmology. 2004;111:2299-306. doi: 10.1016/j.ophtha.2004.06.014.
- Ruggieri S, Frassanito MA, Dammacco R, Guerriero S. TREG lymphocytes in autoimmune uveitis. Ocul Immunol Inflamm. 2012;20:255-261. doi: 10.3109/09273948.2012.681830.
- Sabri K, Saurenmann RK, Silverman ED, Levin AV. Course, complications, and outcome of juvenile arthritis-related uveitis. J AAPOS. 2008;12:539-545. doi: 10.1016/j.jaapos.2008.03.007.
- Saurenmann RK et al. Risk factors for development of uveitis differ between girls and boys with juvenile idiopathic arthritis. Arthritis Rheum. 2010;62:1824-1828. doi: 10.1002/art.27416.
- Seal DV. The effect of ageing and disease on tear constituents. Trans Ophthalmol Soc UK. 1985;104: 355-362.
- Sen ES, Dick AD, Ramanan AV. Uveitis associated with juvenile idiopathic arthritis. Nat Rev Rheumatol. 2015;11:338-348. doi: 10.1038/nrrheum.2015.20.
- Shau H, Kim A, Golub SH. Modulation of natural killer and lymphokine-activated killer cell cytotoxicity by lactoferrin. J Leukoc Biol. 1992;51:343-349.
- Sim KT, Venning HE, Barrett S, et al. Extended oligoarthritis and other risk factors for developing JIA-associated uveitis under ILAR classification and its implication for current screening guideline. Ocul Immunol Inflamm. 2006;14:353-357. doi: 10.1080/09273940600977233.
- Skarin A, Elborgh R, Edlund E, Bengtsson-Stigmar E. Long-term follow-up of patients with uveitis associated with juvenile idiopathic arthritis: a cohort study. Ocul Immunol Inflamm. 2009;17:104-108. doi: 10.1080/09273940802650398.
- Sorimachi K, Akimoto K, Hattori Y, et al. Activation of macrophages by lactoferrin: Secretion of TNF-alpha, IL-8. Biochem Mol Biol Int. 1997;43:79-87. doi: 10.1080/15216549700203841.
- de Souza GA, Godoy LM, Mann M. Identification of 491 proteins in the tear fluid proteome reveals a large number of proteases and protease inhibitors. Genome Biol. 2006;7:72-5. doi: 10.1186/gb-2006-7-8-r72.
- Tan KO, Sack RA, Holden BA, Swarbrick HA. Temporal sequence of changes in tear film composition during sleep. Curr Eye Res. 1993;12:1001-1007. doi: 10.3109/02713689309029226.
- Thorne JE, Woreta F, Kedhar SR, et al. Juvenile idiopathic arthritis-associated uveitis: incidence of ocular complications and visual acuity loss. Am J Ophthalmol. 2007;143(5):840-6. doi: 10.1016/j.ajo.2007.01.033.
- Tiffany JM. Tears in Health and Disease. Eye. 2003;17:923-926. doi: 10.1038/sj.eye.6700566.
- Tomosugi N, Kitagawa K, Takahashi N, et al. Diagnostic potential of tear proteomic patterns in Sjögren’s syndrome. J Proteome Res. 2005;4:820-5. doi: 10.1021/pr0497576.
- Tugal-Tutkun I. Pediatric uveitis. J Ophthalmic Vis Res. 2011;6:259-69.
- Valore EV, Park CH, Igreti SL, Ganz T. Antimicrobial components of vaginal fluid. Am J Obstet Gynecol. 2002;187:561-568. doi: 10.1067/mob.2002.125280.
- Vastert SJ, Bhat P, Goldstein DA. Pathophysiology of JIA-associated uveitis. Ocul Immunol Inflamm. 2014;22:414-423. doi: 10.3109/09273948.2014.926937.
- Versura P, Bavelloni A, Blalock W, et al. A rapid standardized quantitative microfluidic system approach for evaluating human tear proteins. Molecular Vision. 2012;18:2526-2537
- Versura P, Bavelloni A, Grillini M, et al. Diagnostic performance of a tear protein panel in early dry eye. Molecular Vision. 2013;19:1247-1257
- Wakabayashi H, Takakura N, Yamauchi K, Tamura Y. Modulation of immunity-related gene expression in small intestines of mice by oral administration of lactoferrin. Clin Vaccine Immunol. 2006;13:239-245. doi: 10.1128/CVI.13.2.239-245.2006.
- Weaver CT, Harrington LE, Mangan PR, et al. Th17: an effector CD4 T cell lineage with regulatory T-cell ties. Immunity. 2006;24(6):677-88. doi: 10.1016/j.immuni.2006.06.002.
- Willermain F, et al. Interplay between innate and adaptive immunity in the development of non-infectious uveitis. Prog Retin Eye Res. 2012;31:182-194. doi: 10.1016/j.preteyeres.2011.11.004.
- Woreta F, Thorne JE, Jabs DA, et al. Risk factors for ocular complications and poor visual acuity at presentation among patients with uveitis associated with juvenile idiopathic arthritis. Am J Ophthalmol. 2007;143(4):647-55. doi: 10.1016/j.ajo.2006.11.025.
- Ying Qian, Nisha R. Acharya. Juvenile idiopathic arthritis associated uveitis. Curr Opin Ophthalmol. 2010;21(6):468-472. doi: 10.1097/ICU.0b013e32833eab83.
- Zannin ME et al. Timing of uveitis onset in oligoarticular juvenile idiopathic arthritis (JIA) is the main predictor of severe course uveitis. Acta Ophthalmol. 2012;90:91-95. doi: 10.1111/j.1755-3768.2009.01815.x.
- Zhang Y, Lima CF, Rodrigues LR. Anticancer effects of lactoferrin: Underlying mechanisms and future trends in cancer therapy. Nutr Rev. 2014;72:763-773. doi: 10.1111/nure.12155.
- Zhou L, Beuerman RW, Chan CM, et al. Identification of tear fluid biomarkers in dry eye syndrome using iTRAQ quantitative proteomics. J Proteome Res. 2009;8:4889-905. doi: 10.1021/pr900686s.
- Zierhut M, Michels H, Stubiger N, et al. Uveitis in children. Int Ophthalmol Clin. 2005;45:135-56. doi: 10.1097/01.iio.0000155903.87679.c2.
- Zimecki M, Mazurier J, Machnicki M, et al. Immunostimulatory activity of lactotransferrin and maturation of CD4-CD8-murine thymocytes. Immunol Lett. 1991;30:119-123. doi: 10.1016/0165-2478(91)90099-V.
Supplementary files









