Woman’s microbiota and pregnancy outcomes
- Authors: Ailamazian E.K.1, Shipitsyna E.V.1, Savicheva A.M.1
-
Affiliations:
- D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
- Issue: Vol 65, No 4 (2016)
- Pages: 6-14
- Section: Articles
- URL: https://journals.eco-vector.com/jowd/article/view/5817
- DOI: https://doi.org/10.17816/JOWD6546-14
- ID: 5817
Cite item
Full Text
Abstract
A local inflammatoMicrobial invasion of amniotic cavity and subsequent infection process are the leading cause of adverse pregnancy outcomes. Intra-amniotic infection can be caused by both pathogenic and opportunistic microorganisms and viruses, but in the vast majority of cases intra-amniotic infection is associated with the normal microflora of different body sites – the vagina, intestines, mouth and respiratory tract. In the paper, current views about the role of infection factor in the adverse pregnancy outcomes, sources and mechanisms of intra-amniotic infection are summarized.
Full Text
Роль инфекции в неблагоприятных исходах беременности
Во время беременности плацента, плодные оболочки и цервикальная слизистая пробка защищают развивающийся плод от патогенных микроорганизмов. Микробная инвазия амниотической полости может привести к ряду неблагоприятных исходов беременности, включая самопроизвольный выкидыш, мертворождение и преждевременные роды. Самопроизвольный выкидыш — это самопроизвольное прерывание беременности в первом триместре беременности (ранний самопроизвольный выкидыш) или во втором триместре беременности (поздний самопроизвольный выкидыш). Под мертворождением понимают гибель плода в третьем триместре беременности. Преждевременными родами считают роды при сроке беременности 37 недель и меньше.
Вклад инфекционного фактора в развитие разных неблагоприятных исходов беременности различен. Накопленные к настоящему времени данные свидетельствуют, что роль инфекции в раннем самопроизвольном выкидыше и мертворождении относительно невелика — до 15 [1] и 10–25 [2] соответственно. В то же время, внутриамниотическая инфекция (или хориоамнионит), под которой понимают инфекцию хориона, амниона, амниотической жидкости, плаценты и любое их сочетание, является причиной примерно 40 % всех случаев преждевременных родов [3] и 60–70 % случаев позднего самопроизвольного выкидыша [1]. Важную роль инфекционного фактора в развитии позднего самопроизвольного выкидыша и преждевременных родов подчеркивает тот факт, что частота острого хориоамнионита составляет 94 % между 21-й и 24-й неделями беременности, 40 % между 29-й и 32-й неделями, 35 % между 25-й и 28-й неделями, 11 % между 33-й и 36-й неделями, 4 % между 37-й и 40-й неделями [4].
Спектр инфекционных агентов, способных вызывать внутриамниотическую инфекцию, исключительно широк. К их числу относятся как патогенные, так и условно-патогенные микроорганизмы и вирусы. Данный обзор литературы посвящен инфекциям, ассоциированным с нормальной (или эндогенной) микрофлорой различных биотопов женщины — влагалища, кишечника, ротовой полости и дыхательных путей.
Нормальная микрофлора нижних отделов репродуктивного тракта женщины в защите от инфекции
Ключевой функцией нормальной микрофлоры влагалища является защита репродуктивных органов женщины от инфекций. Первая линия защиты от возбудителей урогенитальных инфекций осуществляется путем сложного взаимодействия между компонентами мукозного врожденного иммунитета, формируемого слизистыми оболочками влагалища и цервикального канала, и нормальной микрофлорой влагалища.
Во влагалище здоровых женщин содержится огромное количество бактерий (в среднем 107 бактерий на 1 г выделений). Основным компонентом нормальной микрофлоры влагалища у большинства женщин репродуктивного возраста являются лактобациллы. Важнейшим механизмом антимикробной защиты является продукция лактобациллами молочной кислоты путем ферментации гликогена, накапливаемого в эпителиальных клетках под влиянием эстрогенов. Молочная кислота обеспечивает низкое значение рН влагалища и ограничивает тем самым размножение патогенных и потенциально патогенных микроорганизмов. Кроме молочной кислоты, лактобациллы влагалища синтезируют другие антимикробные вещества, такие как перекись водорода и бактериоцины — специфические белки, подавляющие жизнедеятельность других бактерий путем повреждения их цитоплазматических мембран. Еще одним способом, посредством которого нормальная микрофлора влагалища осуществляет антагонизм в отношении других бактерий, является конкуренция за пищевые субстраты и сайты адгезии к эпителию влагалища [5].
Результаты исследований последних лет показывают, что до трети здоровых женщин имеют «нелактобациллярный» тип физиологического микробиоценоза, представленный спектром анаэробных бактерий. Доминирующими бактериями во влагалище женщин с таким типом микробиоценоза являются представители бактериальных родов Gardnerella, Atopobium, Prevotella, Megasphaera, Dialister, Peptoniphilus, Sneathia, Eggerthella, Aerococcus, Finegoldia, Mobiluncus. Отмечено, что у всех женщин с данным вариантом микробиоценоза присутствуют (хотя часто в небольшом количестве) бактерии, способные продуцировать молочную кислоту [6, 7]. Частота встречаемости «нелактобациллярного» варианта нормальной микрофлоры существенно варьирует в зависимости от этнической/расовой принадлежности [6].
Микрофлора влагалища претерпевает значительные структурные изменения на протяжении жизни женщины, которые напрямую связаны с уровнем эстрогенов. Факторами, определяющими изменчивость микрофлоры влагалища, являются наступление или прекращение менархе, фаза менструального цикла, сексуальная активность женщины, тип микробиоценоза (свойства доминирующих бактерий). Отдельного внимания заслуживает вопрос об изменениях микрофлоры влагалища, связанных с беременностью. В целом микрофлора влагалища у здоровых беременных женщин стабильна на протяжении всей беременности и отличается меньшим разнообразием (с подавляющим доминированием Lactobacillus crispatus и L. iners), чем у здоровых небеременных женщин [8–10]. Факторами, способствующими стабильности микрофлоры влагалища при беременности, могут быть отсутствие циклических гормональных флуктуаций, менструальных кровотечений, а также снижение сексуальной активности [10].
Так же как и у небеременных женщин, у части беременных женщин нормальный микробиоценоз влагалища может состоять не из лактобацилл, а из спектра преимущественно анаэробных микроорганизмов, хотя среди беременных женщин такой тип микробиоценоза встречается реже. Однозначного ответа, связан ли «нелактобациллярный» тип физиологического микробиоценоза с повышенным риском осложнений беременности, в первую очередь преждевременных родов, на сегодняшний день нет, так как имеющиеся данные противоречивы [8, 9].
Источники и механизмы внутриамниотической инфекции
Пути микробной инвазии амниотической полости
Во время беременности оболочки плода являются механическим и иммунным барьером для микроорганизмов. Исходом микробной контаминации околоплодных вод не всегда является развитие клинически значимой воспалительной реакции. Так, частота выявления микроорганизмов в околоплодных водах у беременных, не имеющих клинических проявлений инфекционного поражения, может доходить до 30 % [11]. Неблагоприятные перинатальные исходы наблюдаются у пациенток, у которых реализуется инфекционный процесс в околоплодных водах [12–14].
Различают три основных пути проникновения инфекционных агентов в полость плодного пузыря:
- восходящий — из нижних отделов генитального тракта (рассматривается как основной путь);
- гематогенный — из хронических очагов инфекции матери;
- ятрогенный — бактериальная инвазия амниотической жидкости при проведении инвазивных диагностических или лечебных процедур.
Микроорганизмы могут оказывать прямое повреждающее действие на плодные оболочки, плаценту, плод, а также действовать опосредованно через систему цитокинов. Бактериальная инфекция является триггером преждевременного прерывания беременности через активацию цитокинового каскада: микробные агенты секретируют фосфолипазу, увеличивая продукцию простагландинов из арахидоновой кислоты в тканях матки, а бактериальные эндотоксины, такие как липополисахариды, действуя на макрофаги в плодных оболочках, стимулируют выработку простагландинов и запускают каскад провоспалительных цитокинов. При распространении возбудителей инфекции восходящим путем оболочки плода подвергаются литическому воздействию протеиназ, вырабатываемых бактериями, и преждевременно разрываются, вызывая отхождение амниотической жидкости [15–17]. Необходимо отметить, что на сегодняшний день до конца не ясно, является ли обширная инвазия плодных оболочек следствием или причиной внутриамниотической инфекции. В недавнем исследовании было показано, что микробная инвазия амниотической полости предшествует обширной инвазии плодных оболочек, а не следует за ней [18]. На основании полученных данных авторы предложили следующую модель микробной инвазии амниотической полости: сначала бактерии проникают в амниотическую полость через дискретный участок хориоамниотической мембраны, после чего происходит их пролиферация в амниотической полости и затем обширная инвазия плодных оболочек [18].
Бактерии, обнаруживаемые при внутриамниотической инфекции
Подавляющее большинство микроорганизмов, обнаруживаемых при внутриамниотической инфекции, принадлежит нормальной микробиоте женщины. Исключив экзогенно приобретаемые бактерии и принимая во внимание, что более триллиона микробных клеток населяют поверхность и полости тела, превышая число клеток тела человека по меньшей мере в 10 раз, можно утверждать, что тело женщины является богатым потенциальным источником оппортунистической микробной инвазии амниотической полости. Микроорганизмы, колонизирующие различные участки тела и способные получить доступ к восходящей миграции или гематогенному пути, могут внести вклад в разнообразие и численность бактерий в амниотической жидкости.
В недавнем систематическом обзоре было показано, что при внутриамниотической инфекции встречаются бактерии, принадлежащие 5 типам, 16 порядкам, 44 родам и 87 различным таксонам [3]. Наиболее широко представленным типом был тип Firmicutes, бактерии этого типа выявлялись у 343 из 349 женщин (98 %). Самым представительным порядком был порядок Mycoplasmatalesс частотой 59 % (205 женщин), а самым представительным родом — род Ureaplasma с частотой 49 % (172 женщины). При внутриамниотической инфекции с высокой частотой выявлялись виды бактерий, известные своим патогенным потенциалом, такие как U. urealyticum (11 %), Streptococcus agalactiae (11 %), Mycoplasma hominis (10 %) и Fusobacterium nucleatum (9 %). В таблице 1 представлены бактериальные таксоны, выявлявшиеся с частотой 1 % и выше.
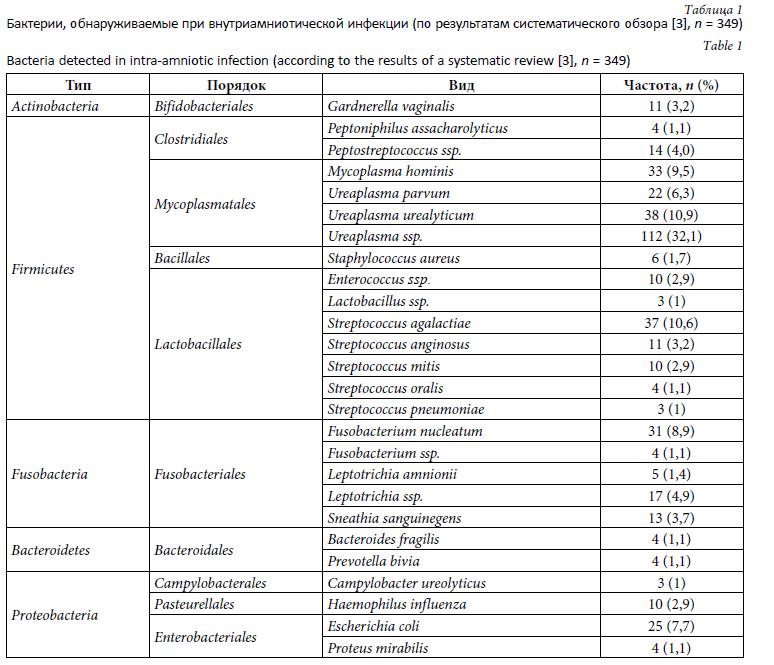
Результаты исследований свидетельствуют, что большинство бактериальных видов, присутствующих с высокой частотой при внутриамниотической инфекции, принадлежат нормальной микрофлоре, главным образом, урогенитального тракта. Отмечено, что при использовании молекулярных методов число выявляемых бактериальных таксонов увеличивается в несколько раз по сравнению с культуральным методом [3]. Полимикробная инвазия амниотической полости имеет место приблизительно в 30 % случаев [12, 19].
Микробиота влагалища
Заболевания влагалища, вызываемые условно-патогенными микроорганизмами, такие как бактериальный вагиноз и аэробный вагинит, вносят существенный вклад в развитие инфекционных осложнений беременности. Бактериальный вагиноз характеризуется замещением лактобациллярной микрофлоры влагалища спектром других микроорганизмов, главным образом анаэробных: G. vaginalis, Atopobium vaginae, Prevotella spp., Mobiluncus spp., Megasphaera spp., Leptotrichia spp., Sneatia spp. и др. [20]. Существует убедительная доказательная база, что бактериальный вагиноз ассоциирован с ранним и поздним самопроизвольным выкидышем, преждевременными родами, преждевременным разрывом плодных оболочек, хориоамнионитом, послеродовым эндометритом [21–24].
Патофизиологические механизмы, определяющие неблагоприятное влияние бактериального вагиноза на течение и исход беременности, до сих пор полностью не ясны. В нескольких исследованиях было показано присутствие ассоциированных с бактериальным вагинозом бактерий в образцах эндометрия при плазмоклеточном эндометрите [25, 26]. Такое воспаление может нарушать физиологический иммуно-гормональный фон в ходе имплантации и раннего развития эмбриона и приводить к выкидышу (на ранних сроках беременности) или преждевременным родам (на поздних сроках беременности). Кроме того, микроорганизмы, населяющие нижние отделы генитального тракта при бактериальном вагинозе, могут восходящим путем проникать в полость матки и достигать децидуальной оболочки. Это может запускать целый ряд процессов, вовлеченных в индукцию преждевременных родов, включая увеличение продукции лейкоцитов, продукцию цитокинов, синтез простагландинов в амнионе, хорионе и миометрии, сокращения матки, расширение шейки матки, что, в свою очередь, способствует дальнейшему проникновению микроорганизмов в полость матки [17]. Далее, ассоциированные с бактериальным вагинозом бактерии могут вырабатывать литические ферменты, такие как сиалидазы и муциназы, которые могут ослаблять защитную цервикальную слизь и способствовать бактериальной инвазии верхних отделов генитального тракта [27]. Однако тот факт, что очень многие беременные женщины с бактериальным вагинозом благополучно вынашивают здорового ребенка, свидетельствует о том, что факторы хозяина способны контролировать эти процессы. Было показано, что генетическая предрасположенность к чрезмерным иммунным реакциям (детерминируемая полиморфизмами в гене TNF-α) в сочетании с бактериальным вагинозом ассоциирована с гораздо более высоким риском преждевременных родов, чем присутствие данного генотипа или наличие данного синдрома по отдельности [28]. Полагают, что в будущем идентификация и количественная оценка факторов иммунного ответа, возможно, будут применяться для выявления тех женщин с бактериальным вагинозом, у которых риск неблагоприятных исходов беременности повышен.
Аэробный, или неспецифический, вагинит — относительно недавно описанная нозологическая форма. Аэробный вагинит характеризуется как инфекционно-воспалительное заболевание влагалища, вызываемое условно-патогенными аэробными бактериями в основном кишечной группы — кишечной палочкой, а также стрептококками, стафилококками, энтерококками [29]. Сходство аэробного вагинита с бактериальным вагинозом заключается в том, что при обоих состояниях наблюдается уменьшение количества лактобацилл, приводящее к снижению концентрации молочной кислоты и, соответственно, повышению рН среды влагалища, и их замещение условно-патогенными микроорганизмами. Различия между этими заболеваниями существенны. Если для бактериального вагиноза характерны отсутствие воспаления и присутствие большого количества анаэробной микрофлоры, то аэробный вагинит в его типичном проявлении характеризуется повышенным воспалительным ответом и/или выраженными признаками атрофии эпителия влагалища и наличием умеренного количества комменсальной кишечной микрофлоры [29]. Чаще всего при аэробном вагините выявляются Streptococcus spp. (до 59 % случаев), Staphylocuccus aureus (до 42 %), коагулазаотрицательные стафилококки (до 37 %), Escherichia coli (до 23 %) [30].
Патогенез аэробного вагинита изучен недостаточно, и его предполагаемую роль в развитии осложнений беременности еще предстоит оценить. Полагают, что большинство случаев гнойно-септических заболеваний матери, плода и новорожденного связано с бактериями, типичными для аэробного вагинита, в то время как ассоциированные с бактериальным вагинозом бактерии чаще выявляются в амниотической полости у женщин с преждевременными родами и преждевременным разрывом плодных оболочек [31–33].
Необходимо отметить роль дрожжеподобных грибов рода Candida, также относящихся к условно-патогенным микроорганизмам, в развитии внутриамниотической инфекции. Показано, что у женщин, становившихся беременными на фоне применения внутриматочных контрацептивов, повышен риск внутриамниотической инфекции, обусловленной C. albicans [34]. Хотя связь между кандидозной инфекцией и использованием внутриматочных контрацептивов была впервые описана уже очень давно [35], только совсем недавно было показано, что кандиды формируют биопленки на внутриматочных контрацептивах, делая их своего рода резервуаром кандидозной инфекции в генитальном тракте [36].
Микробиота кишечника
Желудочно-кишечный тракт населен огромным спектром микроорганизмов, которые участвуют в метаболизме хозяина, защищают кишечник от инфекции и модулируют функции иммунной системы хозяина [37]. Полагают, что кишечная микрофлора также может служить источником внутриамниотической инфекции, так как представители кишечной микрофлоры обнаруживаются в амниотической жидкости женщин с преждевременным разрывом плодных оболочек [14]. Согласно данным систематического обзора G.L. Mendz et al. (2013), такие представители нормальной микрофлоры кишечника, как E. coli, S. agalactiae или Enterococcus spp., выявляются из амниотической жидкости у каждой пятой женщины с внутриамниотической инфекцией [3]. Считается, что в подавляющем большинстве случаев кишечные микроорганизмы колонизируют влагалище и затем достигают внутриматочную полость восходящим путем [38]. Гематогенный путь инвазии внутриматочной полости хорошо описан для возбудителя кишечных инфекций Listeria monocytogenes. Эти бактерии хорошо известны своей способностью преодолевать слизистые барьеры кишечника и гематогенным путем проникать в ткани плаценты [39]. Хотя листерии нельзя отнести к нормальной микрофлоре кишечника и, ввиду специфических особенностей данного микроорганизма, их свойства нельзя автоматически переносить на другие бактерии, теоретически гематогенный путь передачи для представителей нормальной микрофлоры кишечника тоже возможен [14].
Микробиота ротовой полости
Ротовая полость имеет свою характерную микробиоту, насчитывающую более 700 видов микроорганизмов [40]. Предположительно основной путь распространения микроорганизмов ротовой полости — гематогенный, особенно при периодонтите [41], однако полагают, что колонизация влагалища микробами из ротовой полости во время рецептивного орального секса также возможна [42].
При внутриамниотической инфекции обнаруживают целый ряд бактерий, ассоциированных с заболеваниями периодонта, их совокупная частота составляет около 13 % всех случаев преждевременных родов [3]. К их числу относятся Bergeyella spp., Dialister spp., F. nucleatum, Oribacterium sinus, Peptostreptococcus oralis, Prevotella oris, Rothia dentocariosa, S. oralis, S. salivarius, Veillonella spp. [3]. Необходимо отметить, что многие из этих бактерий могут колонизировать также кожу лица, например S. salivarius и F. nucleatum, и/или влагалище, например P. oralis, P. oris, S. salivarius, Veillonella spp. и Dialister spp. Так, был описан случай выявления одного и того же штамма Bergeyella spp. в амниотической жидкости и субгингивальной бляшке у женщины с хориоамнионитом, при этом во влагалище этот микроорганизм не обнаружили [43]. Capnocytophaga spp. является компонентом нормальной микрофлоры ротовой полости, но может быть также задействована в развитии септицемии и реже хориоамнионита и неонатальных инфекций. В ряде случаев этот микроорганизм проникает в амниотическую полость из влагалища восходящим путем, но известны случаи сепсиса, связанного с Capnocytophaga spp., когда во влагалище бактерии не обнаруживались, что свидетельствовало о гематогенном распространении из ротовой полости [44]. Доказательства того, что бактерии ротовой полости F. nucleatum могут инфицировать плаценту гематогенным путем и быть причиной неблагоприятных исходов беременности, были получены в экспериментах на беременных мышах. Было показано, что в результате внутривенных инъекций, содержащих F. nucleatum, бактерии колонизировали плаценту и быстро пролиферировали, индуцируя смерть плода в результате инфекции, локализованной в матке, при этом системная инфекция не развивалась [45].
Обнаружение бактерий ротовой полости в амниотической полости женщин с преждевременными родами согласуется с данными недавнего метаанализа, включившего более 12 тысяч женщин, результаты которого показали значительную ассоциацию преждевременных родов с периодонтитом у женщины [46]. Эти данные говорят в пользу того, что гематогенная диссеминация бактерий ротовой полости является одним из путей достижения амниотической полости.
Микрофлора дыхательных путей
В амниотической полости женщин с неблагоприятными исходами беременности могут обнаруживаться бактерии, колонизирующие респираторный тракт, такие как Haemophilus influenza, H. parainfluenza, S. pneumoniae [47]. Хотя эти микроорганизмы могут также присутствовать во влагалище [6], у женщин с острыми респираторными инфекциями, вызванными этими бактериями, инфекция может достигать плаценты гематогенным путем на любом сроке беременности, индуцируя самопроизвольный выкидыш, преждевременные роды, пороки плода или внутриутробную смерть плода [47]. Бактерии H. influenzae ответственны за неонатальный менингит и инфекции респираторного тракта у детей. В урогенитальном тракте его обнаруживают не часто, тем не менее описаны случаи внутриамниотической инфекции, сопровождавшиеся выделением возбудителя при культуральном исследовании крови [48]. Описан случай сепсиса вследствие инфекции, вызванной H. influenzae, приведшей к самопроизвольному выкидышу [49]. S. pneumoniae колонизирует верхние дыхательные пути у здоровых носителей, но может быть причиной пневмонии, менингита, бактериемии и сепсиса у восприимчивых к инфекции лиц. Эти бактерии редко ассоциированы с гинекологическими инфекциями, однако известны случаи выявления микроорганизма при внутриамниотической инфекции (в отсутствие признаков инфекции влагалища), имевшей своим следствием септический аборт [50]. Недавно был также описан случай мертворождения у женщины с инфекцией верхних дыхательных путей, обусловленной F. nucleatum. Микроорганизм был выделен из плаценты и в органах плода, и тот же самый штамм был идентифицирован у нее в субгингивальной бляшке, но не во влагалище и не в прямой кишке [51].
Таким образом, опубликованные данные свидетельствуют о вовлеченности микрофлоры экстрагенитальной локализации в развитие внутриамниотической инфекции. Обнаружение одного и того же микроорганизма одновременно в типичном для него эпитопе и в амниотической полости говорит в пользу гематогенной микробной инвазии.
Заключение
Внутриамниотическая инфекция является одной из ведущих причин неблагоприятных исходов беременности. Подавляющее большинство микроорганизмов, обнаруживаемых при внутриамниотической инфекции, относится к нормальной микробиоте, главным образом, нижних отделов урогенитального тракта. Разработка ранних специфических маркеров микробной инвазии амниотической полости и развития внутриамниотической инфекции будет способствовать разработке стратегий предотвращения неблагоприятных исходов беременности.
About the authors
Eduard K. Ailamazian
D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
Author for correspondence.
Email: iagmail@ott.ru
Professor, Academician of RAS, Director Russian Federation
Elena V. Shipitsyna
D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
Email: iagmail@ott.ru
PhD, Senior Researcher, Laboratory of Microbiology Russian Federation
Alevtina M. Savicheva
D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
Email: savitcheva@mail.ru
MD, Professor, Head of Laboratory of Microbiology Russian Federation
References
- Giakoumelou S, Wheelhouse N, Cuschieri K, et al. The role of infection in miscarriage. Hum Reprod Update. 2016;22(1):116-33. doi: 10.1093/humupd/dmv041.
- McClure EM, Goldenberg RL. Infection and stillbirth. Semin Fetal Neonatal Med. 2009;14(4):182-9. doi: 10.1016/j.siny.2009.02.003.
- Mendz GL, Kaakoush NO, Quinlivan JA. Bacterial aetiological agents of intra-amniotic infections and preterm birth in pregnant women. Front Cell Infect Microbiol. 2013;3:58. doi: 10.3389/fcimb.2013.00058.
- Russell P. Inflammatory lesions of the human placenta: clinical significance of acute chorioamnionitis. Am J Diagn Gynecol Obstet. 1979;2:127-37.
- Petrova M, Lievens E, Malik S, et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health. Front Physiol. 2015;6:81. doi: 10.3389/fphys.2015.00081.
- Ravel J, Gajer P, Abdo Z, et al. Vaginal microbiome of reproductive-age women. Proc Natl Acad Sci USA. 2011;108: S4680-S7. doi: 10.1073/pnas.1002611107.
- Zhou X, Hansmann MA, Davis CC, et al. The vaginal bacterial communities of Japanese women resemble those of women in other racial groups. FEMS Immunol Med Microbiol. 2010;58:169-81. doi: 10.1111/j.1574-695X.
- 00618.x.
- DiGiulio DB, Callahan BJ, McMurdie PJ, et al. Temporal and spatial variation of the human microbiota during pregnancy. Proc Natl Acad Sci USA. 2015;112(35):11060-5. doi: 10.1073/pnas.1502875112.
- Romero R, Hassan SS, Gajer P, et al. The composition and stability of the vaginal microbiota of normal pregnant women is different from that of non-pregnant women. Microbiome. 2014;2(1):10. doi: 10.1186/2049-2618-2-10.
- Walther-António MR, Jeraldo P, Berg Miller ME, et al. Pregnancy’s stronghold on the vaginal microbiome. PLoS One. 2014;9(6):e98514. doi: 10.1371/journal.pone.0098514.
- Gibbs RS, Blanco JD, St Clair PJ, Castaneda YS. Quantitative bacteriology of amniotic fluid from women with clinical intraamniotic infection at term. J Infect Dis. 1982;145(1):1-8. doi: 10.1093/infdis/145.1.1.
- Romero R, Miranda J, Chaiworapongsa T, et al. A no¬vel molecular microbiologic technique for the rapid diagnosis of microbial invasion of the amniotic cavity and intra-amniotic infection in preterm labor with intact membranes. Am J Reprod Immunol. 2014;71(4):330-58. doi: 10.1111/aji.12189.
- Romero R, Espinoza J, Goncalves LF, et al. Inflammation in preterm and term labour and delivery. Semin Fetal Neonatal Med. 2006;11:317-26. doi: 10.1016/j.siny.2006.05.001
- DiGuilio DB, Romero R, Kusanovic JP. Prevalence and diversity of microbes in the amniotic fluid, the fetal inflammatory response, and pregnancy outcome in women with preterm pre-labor rupture of membranes. Am J Reprod Immunol. 2010;64:38-57. doi: 10.1111/j.1600-0897.2010.00830.x.
- Muglia LJ, Katz M. The enigma of spontaneous preterm birth. N Engl J Med. 2010;362:529-35. doi: 10.1056/NEJMra0904308.
- Adams Waldorf KM, Rubens CE, Gravett MG. Use of nonhuman primate models to investigate mechanisms of infection-associated preterm birth. BJOG. 2011;118:136-44. doi: 10.1111/j.1471-0528.2010.02728.x.
- Keelan JA, Blumenstein M, Helliwel RJ. Cytokines, prostaglandins and parturition — a review. Placenta. 2003;24(SupplA): S33-46.
- Kim MJ, Romero R, Gervasi MT, Kim JS. Widespread microbialinvasion of the chorioamniotic membranes is a consequence and not a cause of intra-amniotic infection. Lab Invest. 2009;89(8):924-36. doi: 10.1038/labinvest.2009.49.
- Romero R, Miranda J, Chaemsaithong P, et al. Sterile and microbial-associated intra-amniotic inflammation in preterm prelabor rupture of membranes. J Matern Fetal Neonatal Med. 2015;28(12):1394-409. doi: 10.3109/14767058.2014.958463.
- Lamont RF, Sobel JD, Akins RA, et al. The vaginal microbiome: new information about genital tract flora using molecular based techniques. BJOG. 2011;118:533-49. doi: 10.1111/j.1471-0528.2010.02840.x.
- Ralph SG, Rutherford AJ, Wilson JD. Influence of bacterial vaginosis on conception and miscarriage in the first trimester: cohort study. BMJ. 1999;319:220-3. doi: 10.1136/bmj.319.7204.220
- Denney JM, Culhane JF. Bacterial vaginosis: a problematic infection from both a perinatal and neonatal perspective. Semin Fetal Neonatal Med. 2009;14(4):200-3. doi: 10.1016/j.siny.2009.01.008.
- Donati L, Di Vico A, Nucci M, et al. Vaginal microbial flora and outcome of pregnancy. Arch Gynecol Obstet. 2010;281(4):589-600. doi: 10.1007/s00404-009-1318-3.
- Romero R, Chaiworapongsa T, Kuivaniemi H, Tromp G.
- Bacterial vaginosis, the inflammatory response and the risk of preterm birth: a role for genetic epidemiology in the prevention of preterm birth. Am J Obstet Gynecol. 2004;190(6):1509-19. doi: 10.1016/j.ajog.2004.01.002.
- Korn AP, Bolan G, Padian N, et al. Plasma cell endometritis in women with symptomatic bacterial vaginosis. Obstet Gynecol. 1995;85:387-90.
- Bennett BB, Clark P, Riley P, et al. The association of asymptomatic bacterial vaginosis with upper genital tract infection. Prim Care Update Ob Gyns.1998;5(4):150. doi: 10.1016/s1068-607x(98)00031-6.
- McGregor JA, French JI, Jones W, et al. Bacterial vaginosis is associated with prematurity and vaginal fluid mucinase and sialidase: results of a controlled trial of topical clindamycin cream. Am J Obstet Gynecol. 1994;170:1048-59. doi: 10.1016/s0002-9378(94)70098-2.
- Macones GA, Parry S, Elkousy M, et al. A polymorphism in the promoter region of TNF and bacterial vaginosis: preliminary evidence of gene-environment interaction in the etiology of spontaneous preterm birth. Am J Obstet Gynecol. 2004;190:1504-08. doi: 10.1016/j.ajog.2004.01.001.
- Donders GG, Vereecken A, Bosmans E, et al. Definition of a type of abnormal vaginal flora that is distinct from bacterial vaginosis: aerobic vaginitis. BJOG. 2002;109(1):34-43. doi: 10.1111/j.1471-0528.2002.00432.x.
- Tansarli GS, Kostaras EK, Athanasiou S, Falagas ME. Prevalence and treatment of aerobic vaginitis among non-pregnant women: evaluation of the evidence for an underestimated clinical entity. Eur J Clin Microbiol Infect Dis. 2013;32(8):977-84. doi: 10.1007/s10096-013-1846-4.
- 31.Donders G, Bellen G, Rezeberga D. Aerobic vaginitis in pregnancy. BJOG. 2011;118(10):1163-70. doi: 10.1111/j.1471-0528.2011.03020.x.
- Gibbs RS. Chorioamnionitis and bacterial vaginosis. Am J Obstet Gynecol. 1993;169:460-2.
- doi: 10.1016/0002-9378(93)90341-f.
- Rezeberga D, Lazdane G, Kroica J, et al. Placental histological inflammation and reproductive tract infections in a low risk pregnant population in Latvia. Acta Obstet Gynecol Scand. 2008;87(3):360-5. doi: 10.1080/00016340801936487.
- Kim SK, Romero R, Kusanovic JP, et al. The prognosis of pregnancy conceived despite the presence of an intrauterine device (IUD). J Perinat Med. 2010;38:45-53. doi: 10.1515/JPM.2009.133.
- Schweid AI, Hopkins GB. Monilial chorionitis associated with an intrauterine contraceptive device. Obstet Gynecol. 1968;31:719-721.
- Auler ME, Morreira D, Rodrigues FF, et al. Biofilm formation on intrauterine devices in patients with recurrent vulvovaginal candidiasis. Med Mycol. 2010;48(1):211-6. doi: 10.3109/13693780902856626.
- Wardwell LH, Huttenhower C, Garrett WS. Current concepts of the intestinal microbiota and pathogenesis of infection. Curr Infect Dis Rep. 2011;13:28-34. doi: 10.1007/s11908-010-0147-7.
- Goldenberg RL, Hauth JC, Andrews WW. Intrauterine infection and preterm delivery. The New England journal of medicine. 2000;342:1500-07. doi: 10.1056/NEJM200005183422007.
- Baud D, Greub G. Intracellular bacteria and adverse pregnancy outcomes. Clin Microbiol Infect. 2011;17:1312-22. doi: 10.1111/j.1469-0691.2011.03604.x.
- Aas JA, Paster BJ, Stokes LN, et al. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol. 2005;43:5721-32. doi: 10.1128/JCM.43.11.5721-5732.2005.
- Bearfield C, Davenport ES, Sivapathasandarem V, ¬Allaker RP. Possible association between amniotic fluid micro-organism infection and microflora in the mouth. BJOG. 2002;109(5):527-33. doi: 10.1111/j.1471-0528.2002.01349.x.
- Alanen A, Laurikainen E. Second-trimester abortion caused by Capnocytophaga sputigena: case report. Am J Perinatol. 1999;16(4):181-3. doi: 10.1055/s-2007-993854.
- Han YW, Ikegami A, Bissada NF, et al. Transmission of an uncultivated Bergeyella strain from the oral cavity to amniotic fluid in a case of preterm birth. J Clin Microbiol. 2006; 44:1475-83. doi: 10.1128/JCM.44.4.1475-1483.2006.
- Lopez E, Raymond J, Patkai J, et al. Capnocytophaga species and prterm birth: case series and review of the literature. Clin Microbiol Infect. 2010;16:1539-43. doi: 10.1111/j.1469-0691.2009.03151.x.
- Han YW, Redline RW, Mei L. Fusobacterium nucleatum induces premature and term still-births in pregnant mice: implication of oral bacteria in preterm birth. Infect Immun. 2004;72(4):2272-9. doi: 10.1128/iai.72.4.2272-2279.2004.
- Konopka T, Paradowska-Stolarz A. Periodontitis and risk of preterm birth and low birth weight- a meta-analysis. Ginekol Pol. 2012;83:446-53.
- Sandu C, Folescu R, Pop E., Motoc AGM. Hematogenous placental infection in acute respiratory infections. Rom J Morphol Embryol. 2013;54:157-61.
- Shute KM, Kimber RG. Haemophilus influenzae intra-amniotic infection with intact membranes. J Am Board Fam Pract. 1994;7:335-41.
- Calner PA, Salinas ML, Steck A, Schechter-Perkins E. Haemophilus influenzae sepsis and placental abruption in an unvaccinated immigrant. West J Emerg Med. 2012;13:133-5. doi: 10.5811/westjem.2011.7.6783.
- Liang S, Yeh J. Septic Abortion due to Streptococcus pneumoniae. Department of Medicine, UCLA. 2005. Available online at: http://www.med.ucla.edu/modules/ wfsection/article.php?articleid=271.
- Han YW, Fardini Y, Casey Chen C, et al. Term stillbirth caused by oral Fusobacterium nucleatum. Obstet Gynecol. 2010;115:442-5. doi: 10.1097/AOG.
- b013e3181cb9955.
Supplementary files








