Expression of CD117 receptor in male gonads in traumatic brain injury
- 作者: Fedotov A.V1, Astrakhantsev A.F2, Mazurova M.P2
-
隶属关系:
- Bureau of Forensic Medicine, Ryazan
- NA. Semashko Central Clinical Hospital № 2
- 期: 卷 13, 编号 1 (2018)
- 页面: 70-74
- 栏目: Articles
- ##submission.dateSubmitted##: 05.01.2023
- ##submission.datePublished##: 15.03.2018
- URL: https://genescells.ru/2313-1829/article/view/120730
- DOI: https://doi.org/10.23868/201805008
- ID: 120730
如何引用文章
全文:
详细
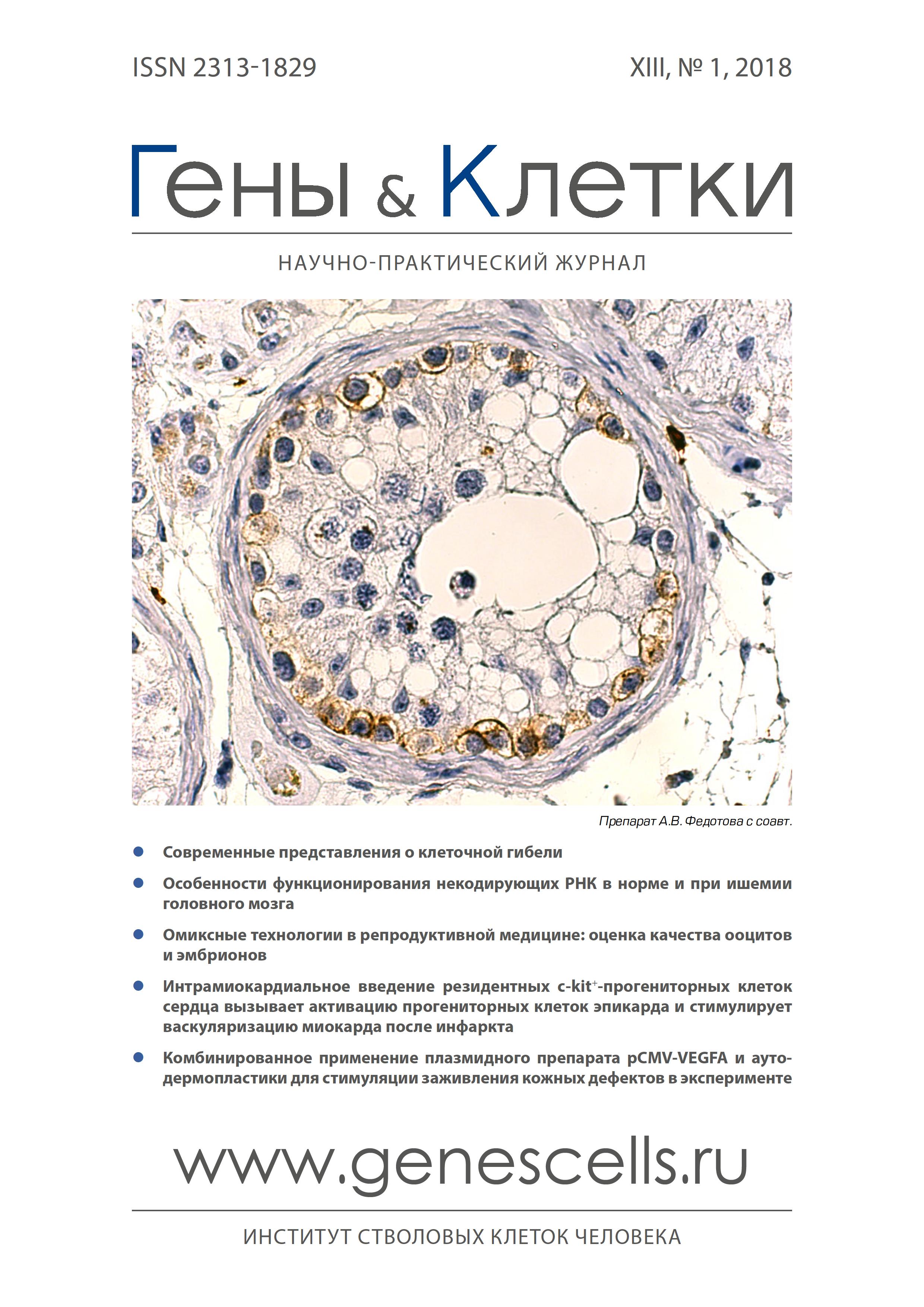
Using the conventional histological methods (staining with hematoxylin and eosin), morphometric (counting the percentage of tubules with impaired spermatogenesis, measuring the crosssectional area of the tubules), as well as immunohistochemical methods of investigation (immunohistochemical staining with antibodies to C-kit (CD117), the gonads of 5 patients, who died from a craniocerebral trauma on the 15-35 day after the injury, and 6 patients who died from a craniocerebral injury at the scene. In both groups, a positive membranous staining of the spermatogonia of the basal section of the epithelio-spermatogenic layer is found, which is more pronounced in individuals who died in the long-term after traumatic brain injury, which may indicate activation of the proliferative activity of the spermatogonial population of regenerative nature. CD117 positive cell, similar to Cajal cells, are also detected in the walls of convoluted seminiferous tubules, located along the periphery of blood vessels, among interstitial endocrinocytes. The number of interstitial endocrinocytes, along with this, increases in the feces of the sex glands of individuals who died in the long-term after the craniocerebral trauma, which indicates their hyperplasia, as a compensatory adaptive response in response to atrophic changes in the epithelio-spermatogenic layer (so-called. "mixed atrophy of the testis”). CD117 positive cells, interacting with smooth muscle cells of the wall of convoluted seminiferous tubules, can participate both in the movement of spermatogenic cells from the basal membrane to the lumen of the tubule, and participate in the formation of the so-called. "Waves of spermatogenesis”, ensuring the movement of spermatogenic cells from the periphery to the middle zone.
全文:
Бведение Рецептор CD117 и его лиганд, фактор стволовых клеток (SCF), представляет собой один из ключевых регуляторов пролиферации, дифференцировки и функции различных клеток. CD117+-клетки были изучены в желудочно-кишечном тракте [1], в органах мочевой системы [2]. У человека они описаны в почечной лоханке, мочеточнике, мочевом пузыре, уретре [3-6]. Экспрессия CD117 была обнаружена в различных нормальных тканях и органах плода и взрослых, таких как мозг, надпочечник, кожа, молочная железа и костный мозг, а также, в некоторых злокачественных новообразованиях человека, таких как опухоли гемопоэтической ткани, рак легких, глиобластома головного мозга, семинома [7]. Гены & Клетки Том XIII, № 1, 2018 ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ 71 Во многих работах показано, что клетки, экспрессирующие CD117, присутствуют в мужских половых железах как в период эмбрионального развития, так и постна-тального и участвуют в трансдукции внеклеточных сигналов, которые контролируют пролиферацию и дифферен-цировку сперматогенных клеток [8]. CD117+-клетки были также обнаружены в интерсти-ции половых желез у больных карциномой предстательной железы [9]. интерес представляет особенность распределения CD117+-клеток в половых железах у больных с гипосперматогенезом, синдромом тестикулярной атрофии и синдромом «Только клетки сертоли» [10]. Однако, исследование CD117+-клетки в половых железах у больных с черепно-мозговой травмой (ЧМТ) не проводилось. в связи с вышеизложенными данными, целью работы является изучение экспрессии СD117 в тканях мужских половых желез в отсроченном периоде после получения ЧМТ. Материал и методы работа проведена с учетом положений Хельсинской декларации - этические принципы медицинских исследований, объектом которых является человек [11]. Были исследованы ткани половых желез 5 умерших через 15-35 сут. после ЧМТ в возрасте 25-44 лет. Контрольная группа-ткани половых желез 6 мужчин того же возраста, погибших от ЧМТ на месте происшествия. Отбор материала проводился с учетом следующих критериев: 1 ) возрастной интервал 25-60 лет, когда морфологическая структура половых желез и процессы сперматогенеза в нормальных условиях характеризуются определенной стабильностью; 2) минимальные (<6,25 %) атеросклеротические изменения в брюшном отделе аорты (для исключения возможных влияний морфологических изменений половых желез, вызванных атеросклеротическим процессом); 3) отсутствие эндокринных нарушений (анализ клинических данных, указанных в истории болезни); 4) отсутствие морфологических проявлений каких-либо эндокринологических заболеваний: макроскопический (локализация, цвет, масса, внешний вид органа на разрезе) и микроскопический (гистоструктура органов при окраске гистологического среза гематоксилином и эозином) анализ секционного материала органов эндокринной системы; 5) отсутствие повреждения гипоталамуса и гипофиза (констатация закрытой ЧМТ травмы по результатам секционного исследования). Половые железы, извлеченные из окружающих тканей через 5-6 ч., но не позднее 10 ч. с момента констатации смерти освобождались от влагалищных оболочек, придатка и подвергались раздельному взвешиванию и определению объема. Оценка морфологического состояния эпителио-сперматогенного слоя проводилась визуально на площади гистологического среза, окрашенного гематоксилином и эозином, путем подсчета доли измененных канальцев, по отношению ко всем канальцам в 7 случайных полях зрения. в качестве морфометрического показателя состояния сперматогенеза также измеряли площадь поперечного сечения канальцев (мкм2) в полуавтоматическом режиме путем окон-туривания полученных при помощи фотоаппарата изображений на микроскопе «AxioImager» (Zeiss, Германия). в каждом случае проводили измерение 30 поперечных срезов канальцев. Площадь поперечного сечения вычисляли с использованием системы анализа изображения «AxioVision 4.7» (Zeiss, Германия). Гистологическое и иммуногистохимическое (ИГХ) исследования проведены в соответствии с рекомендациями С.В Петрова и Н.Т. Райхлина (2012) [7]. Материал фиксировали в течение 24 ч. в 10 % растворе нейтрального формалина (pH 7,0±0,2). Фрагменты тканей после обезвоживания в гистопроцессоре карусельного типа STP120 (ThermoScientific Microm, США) заливали в парафин в модульной системе заливки TES-99 (Medite, Германия). Гистологические срезы толщиной 3-4 мкм изготавливали на ротационном микротоме HM340E (Microm, США), окрашивали гематоксилином и эозином в автомате для окрашивания срезов HMS 70 (ThermoScientific Microm, США). Для ИГХ-исследования были использованы коммерческие поликлональные кроличьи антитела к CD117 (c-kit) фирмы Dako (Дания). Гистологические срезы наносили на высокоадгезивные стекла (ThermoScientific, США), высушивали в течение 2 ч. при температуре 58 0С, затем 18 ч. при температуре 37 0С. Антигенную активность восстанавливали на водяной бане WB-4MS (BioSan, Латвия) в растворе Target Retrieval Solution pH 9 (Dako, Дания). Дальнейшие операции с препаратами проводили во влажной камере Slide Master (BioOptica, Италия). Инактивацию эндогенной пероксидазной активности осуществляли с помощью инкубирования с блокирующим раствором (Dako, Дания) в течение 15 мин. Далее проводили инкубацию с первичными антителами при температуре 4-8 0С в течение 18 ч., затем инкубацию с вторичными антителами в системе детекции REAL EnVision Detection System, Peroxidase/DAB+, Rabbit/Mouse (Dako, Дания) в течение 30 мин. при комнатной температуре, с последующей двукратной инкубацией с диаминбензидином в хромогенном растворе (Dako, Дания) в течение 3 мин. при комнатной температуре. После каждого этапа обработки антителами срезы промывали в фосфатном солевом буфере (Cell Marque, США). На последнем этапе препараты докрашивали гематоксилином Майера (Dako, Дания) и заключали в синтетическую смолу (Shandon-Mount, Thermo Fisher Scientific, США). Также проведены реакции в положительных и отрицательных контролях. Гистологические и ИГХ-срезы анализировали на микроскопе AxioImager Z1 (Zeiss, Германия), фотосъемку осуществляли камерой AxioCam (Zeiss, Германия) с последующей обработкой изображений в программе AxoVision, version 4.7 (Zeiss, Германия). Статистическая обработка материала проводилась с помощью пакета программ Microsoft office. Результаты Анализ гистологической структуры половых желез в контрольной группе лиц, погибших от ЧМТ на месте происшествия, не выявил каких-либо патологических изменений. Средняя площадь поперечного сечения извитых семенных канальцев составляла 35,2х 103±3,7 мкм2. Все 6 типичных клеточных ассоциаций, согласно классификации Y. Clermont [12] прослеживались в большинстве исследованных канальцев. Прослойки интерстициальной соединительной ткани были тонкие, нежные. Интерстициальные эндокриноциты - клетки Лейдига в количестве 3-4 клеток на поперечный срез канальца, имели типичное строение. При исследовании экспрессии CD117-положительно окрашенные клетки в половых железах мужчин, погибших в результате ЧМТ на месте происшествия, обнаруживались как в эпителио-сперматогенном слое извитых семенных канальцев, в их стенке, так и в интерстиции. В эпи-телио-сперматогенном слое среди сперматогоний были выявлены группы клеток с положительным мембранным окрашиванием. Окрашивание отмечалось в сперматого-ниях А-темного типа и А-бледного типа (рис. 1). Гены & Клетки Том XIII, № 1, 2018 72 ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ Рис. 1. Эпителио-сперматогенный слой в извитых семенных канальцах мужчины 22 лет: контрольная группа. иммуногистохимическая реакция с антителами к CD 117, докраска: гематоксилин. Ув. х400 Рис. 2. распределение CD 117-положительных клеток в глубоких слоях стенки извитых семенных канальцев мужчины 29 лет: контрольная группа. иммуногистохимическая реакция с антителами к CD 117, докраска: гематоксилин. Ув. х400 Рис. 3. Контакт ГО117+-клеток со стенкой венулы в интерстиции половых желез мужчины 25 лет: контрольная группа, докраска: гематоксилин. Ув. х400 Рис. 4. Кахале подобные клетки в очаге гиперплазии интерстициальных эндокриноцитов в половых желез мужчины 39 лет: контрольная группа, докраска: гематоксилин. иммуногистохимическая реакция с антителами к CD117. Ув. х400 в стенке семенных канальцев CD117+-клетки имели вытянутую, отростчатую, иногда округлую или овальную форму с различной степенью выраженности окрашивания. расположение этих перитубулярных 0D117+-клеток было различным по отношению к наружным и внутренним слоям стенки канальца. в одних полях зрения обнаруживалось простое прилегание CD117+-клеток к наружным слоям стенки канальца, в других-они располагались в стенке канальца между миоидными элементами и их отростками, а также пучками коллагеновых волокон (рис. 2), и в некоторых случаях - вблизи базальной мембраны канальца или даже в тесном контакте с этой мембраной. в межканаль-цевой интерстициальной соединительной ткани CD117+-клетки были распределены равномерно. Отмечались контакты 0D117+-клеток со стенками кровеносных сосудов микроциркуляторного русла: артериолами, капиллярами, венулами (рис. 3). в отдельных полях зрения были видны CD117+-клетки в контакте с нервными волокнами, интерстициальными эндокриноцитами (рис. 4). Анализ гистологических срезов в группе летальных случаев в отдаленные сроки после ЧМТ показал, что количество канальцев с дифференцированными клеточными ассоциациями, согласно классификации Y. Clermont [12], составило в среднем лишь 41,4±5,7 % от всех поперечных срезов канальцев на плоскости гистологического среза. Канальцы, не содержащие сперматид, но имеющие в своем составе сперматоциты и сперматогонии рассматриваются как неполные (недифференцированные) клеточные ассоциации. Среднее количество канальцев с недифференцированными клеточными ассоциациями равнялось 31,4±5,8 % от всех канальцев на плоскости среза. Средняя площадь поперечного сечения канальцев составила 31,8х103±4,2 мкм2, статистически достоверно (p<0,05, t-2,1) уменьшена на 11 %, по сравнению с контрольной группой. В извитых семенных канальцах половых железах определялось очаговое уменьшение количества сперматогенных клеток (рис. 5). В некоторых канальцах обнаруживалось полное отсутствие всех типов сперматоген-ных клеток за исключением сперматогоний. На поперечном срезе в других канальцах определялись сегментарные зоны «выпадения» сперматогенных клеток, которые равнялись 1/4 площади поперечного сечения. Встречались канальцы, в которых указанные зоны составляли до 1/2 площади поперечного сечения. Обнаруживались также канальцы, в которых отсутствие сперматогенных клеток достигало 3/4 площади поперечного сечения Гены & Клетки Том XIII, № 1, 2018 ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ 73 рис. 5. Структура половых желез мужчины 44 лет, погибшего в отдаленные сроки после ЧМТ: «пестрая атрофия половых желез». Окраска: гематоксилин и эозин. Ув. х200 рис. 6. Выраженная мембранная экспрессия CD117 в большинстве сперматогоний. Иммуногистохимическая реакция с антителами к CD117, докраска: гематоксилин. Ув. х400 : J рис. 7. Кахале-подобные клетки в стенке семенного канальца: синдром «только клетки Сертоли». Иммуногистохимическая реакция с антителами к CD117, докраска: гематоксилин. Ув. х900 рис. 8. Очаговое увеличение Кахале-подобных клеток в межканальцевой соединительной ткани. Иммуногистохимическая реакция с антителами к CD117, докраска: гематоксилин. Ув. х400 и более. Наряду с этим определялись отдельные канальцы или даже группы канальцев, в которых были сохранены только сустентоциты, что свидетельствовало об очаговом синдроме «Только клетки Сертоли» [5]. Среднее количество подобных канальцев составляло 24,2±5,2 % от всех канальцев на плоскости среза. Все это внешне придавало гистологической картине полиморфный вид, что и послужило поводом для некоторых исследователей называть такую картину «пестрой атрофией половых желез» (рис. 5). Интерстициальные эндокриноциты по периферии канальцев с дифференцированными клеточными ассоциациями так же, как и в контрольной группе были немногочисленны. В то время как по периферии зон канальцев с неполными клеточными ассоциациями, их количество было увеличено до 6-8 клеток на поперечный срез, а в отдельных полях зрения они были значительно гиперплазированы и формировали компактные клеточные скопления. Мембранная экспрессия CD117 в эпителио-сперма-тогенном слое канальцев с недифференцированными клеточными ассоциациями была выражена интенсивно в сперматогониях А-темного типа, А-бледного типа, а также в сперматогониях, изолированно расположенных, имеющих удлиненные ядра (рис. 6). В подобных канальцах CD117+-сперматогонии располагались непрерывной цепочкой. Практически лишь единичные сперма-тогонии не имели положительного окрашивания. Среди резко уменьшенного числа сперматогенных клеток более поздних этапов дифференцировки определялись первичные сперматоциты, преимущественно на стадии пахитены, сперматиды отсутствовали. Крупные вакуоли в эпителио-сперматогенном слое указывали на места расположения погибших сперматоцитов. В половых железах как в группе погибших в отдаленные сроки после черепно-мозговой травмы, так и в контрольной группе, не было обнаружено положительной реакции с CD1 1 7 в сустентоцитах, а также в других типах спер-матогенных клеток: сперматоцитах I, II порядка, ранних и поздних сперматидах. Вместе с этим, в утолщенных и деформированных стенках извитых семенных канальцев определялись Кахале-подобные клетки CD117+ даже в случаях с полной герминальной аплазией и синдромом «только клетки Сертоли» (рис. 7). В интерстиции половых желез в отдаленные сроки после ЧМТ отмечалась гиперплазия интерстициальных эндокриноцитов, а также гиперплазия CD117+-клеток, имеющая очаговый характер (рис. 8). Как правило, очаги гиперплазии обнаруживались Гены & Клетки Том XIII, № 1, 2018 74 ОРИГИНАЛьНыЕ ИССЛЕДОВАНИЯ вблизи канальцев с выраженными атрофическими изменениями эпителио-сперматогенного слоя. Обсуждение Изменения, обнаруженные нами в мужской половой железе при ЧМТ, представляют определенный интерес. С одной стороны, значительная частота повреждений головы и высокая смертность при ЧМТ, в сочетании с поражением наиболее трудоспособной категории населения, придают большую социально-медицинскую значимость проблеме черепно-мозгового травматизма. С другой стороны, актуальность изучения изменений, происходящих в гипота-ламо-гипофизарной системе и, особенно, в органах эндокринной системы (в том числе и в половых железах) при черепно-мозговой травме обусловлена важностью этой системы в поддержании гомеостаза организма [13]. И, наконец, у целого ряда больных, перенесших ЧМТ, развиваются нарушения сексуальной и репродуктивной функций, в основе которых лежит морфофункциональная недостаточность, весьма характерная для вторичного гипогонадизма [14]. Проведенные ранее морфологические исследования тканей мужских половых желез при внезапной сердечной смерти [15], атеросклерозе [16] и наркомании [17] позволили выявить стереотипность изменений эпителио-спер-матогенного слоя и эндокринного аппарата половых желез, что давало возможность предположить аналогичный характер изменений при ЧМТ. Однако морфологические изменения мужских половых желез при ЧМТ, в том числе изменения иммунногистохимических характеристик, до настоящего времени остаются практически неизученными. Полученные нами данные свидетельствуют о том, что в половых железах больных, перенесших черепно-мозговую травму, в отдаленные сроки наблюдается уменьшение площади поперечного сечения канальцев на 11 %, дезорганизация эпителио-сперматогенного слоя, заключающаяся в уменьшении частоты встречаемости типичных клеточных ассоциаций, и очаговое «выпадения» спер-матогенных клеток. Все это, в целом, ведет к развитию очагового морфологического синдрома «только клетки Сертоли» Изменения интерстициальных эндокриноцитов имеют характер очаговой гиперплазии. Распределение CD117+-клеток в паренхиме мужских половых желез было наиболее детально изучено в условиях обструктивной и необструктивной азооспермии, а также при тестикулярной атрофии и синдроме «Только клетки Сертоли» [10]. В связи с этим, полученные нами данные о том, что в отдаленные сроки после ЧМТ обнаруживаются выраженные деструктивные изменения эпителио-сперматогенного слоя, приобретающие впоследствии характер полной герминальной аплазии (синдром «только клетки Сертоли»), имеют, несомненно, не только научный интерес, но и практическую значимость. Как было установлено нами ранее, индуцированная ЧМТ деструкция сперматогенных клеток ведет к активизации пролиферативных процессов в сохранившихся сперматогониях эпителио-сперматогенного слоя. [18]. Следовательно, особую важность имеют полученные данные об усилении мембранной экспрессии CD117 в спер-матогониях различных типов (А-темного типа, А-бледного типа, а также в сперматогониях, изолированно расположенных, имеющих удлиненные ядра). Хорошо известен факт усиления пролиферативной активности и дифференциров-ки гемопоэтических клеток, меланоцитов и клеток Кахаля желудочно-кишечного тракта под влиянием CD117 [19]. В отдаленные сроки после ЧМТ, по-видимому, под воздействием CD117 также происходит усиление пролифератив-ной активности и дифференцировки сперматогоний. Таким образом, возможно, реализуется постатрофическая регенерация популяции сперматогенных клеток после их повреждения. СD117+-клетки, расположенные в различных слоях стенки канальцев, взаимодействуя с гладкомышечными клетками стенки канальцев, вероятно, обеспечивают не только перемещение сперматогенных клеток из базального отдела эпителио-сперматогенного слоя в адлюминаль-ный, но и играют важную роль в сокращении стенки канальца и перемещении сперматогенных клеток в продольном направлении: от периферии к области сети средостения половой железы - т. н. «волну сперматогенеза» [20]. Особый интерес представляет контакт интерстициальных эндо-криноцитов половых желез с Кахале-подобными клетками стромы. Он, несомненно, указывает на тесную морфофункциональную взаимосвязь между этими клетками.×
作者简介
A. Fedotov
Bureau of Forensic Medicine, Ryazan
A. Astrakhantsev
NA. Semashko Central Clinical Hospital № 2
Email: afastra@mail.ru
M. Mazurova
NA. Semashko Central Clinical Hospital № 2
参考
- Hanani M., Freund H.R. Interatitial cells of Cajal - their role in pacing and signal transmission in the digestive system. Acta Physiol. Scand. 2000; 170(3): 177-90.
- Metzger R., Schuster T., Till H. et al. Cajal-like cells in the upper urinary tract: comparative study in various species. Pediatr. Surg. Int. 2005; 21(3): 169-74.
- Exintaris B., Klemm M.F., Lang R.J. Spontaneous slow wave and contractile activity of the guinea pig prostate. J. Urol. 2002; 168: 315-22.
- Solari V., Piotrowska A.P., Puri P. Altered expression of interstitial cells of Cajal in congenital ureteropelvic junction obstruction. J. Urol. 2003; 170: 2420-2.
- Петров С.В., Райхлин Н.Т. Руководство по иммуногистохимической диагностике опухолей человека. 4-е изд. доп. и перераб. Казань: Татмедиа; 2012.
- Piaseczna-Piotrowska A.M., Dzieniecka M., Kulig A. et al. Different distribution of c-kit positive interstitial cells of Cajal-like in children’s urinary bladders. Folia Histochem. Cytobiol. 2011; 49(3):431-5.
- Strohmeyer T., Reese D., Press M. et al. Expression of the protooncogene c-kit and its ligand stem cell factor (SCF) in normal and malignant tissue of the human testicles. J. Urol. 1995; 153: 511-5.
- Prabhu S.M., Meistrich M.L., McLaughlin E.A. et al. Expression of c-kit receptor and protein mRNA in the developing, adult and irradiated rodent ovary. Reprod. 2006; 131: 489-99.
- Rodriguez H., Espinoza-Navarro O., Sarabia L. et al. Histological and functional organization in human testicle expression of receptors c-kit and androgens. Int. J. Morphol, 2008; 26(3): 603-8.
- Hasirci E., Turunc T., Bal N. et al. Hasirci E., Turunc T., Bal N. Distribution and number of Cajal-like cells in testis tissue with azoospermia. Kaohsiung J. Med. Sci. 2017; 33(4): 181-6.
- World Medical Association Declaration of Helsinki Ethical Principles for Medical Research Involving Human Subjects. November 27, 2013.
- Rupert P.A. The Cycle of the Seminiferous Epithelium in Humans: A Need to Revisit? J. Androl. 2008; 29: 469-87.
- Прошина Ю.В., Папков В.Г. Структура гипоталамических ядер при тяжелой черепно-мозговой травме. Судебно-медицинская экспертиза 2007; 1: 13-5.
- Карашева Б.Г., Кибрик Н.Д. Сексуальные дисфункции в отдаленном периоде черепно-мозговой травмы. Соц. и Клин. Психиатр. 2013; 23: 106-9.
- Астраханцев А.Ф. Нарушения сперматогенеза у больных атеросклерозом. В: Материалы Юбилейной научной конференции, Россия. Рязань; 2000. с. 38-9.
- Krupnov N., Astrakhantsev A. Morphological changes of testis in atherosclerosis. Virchows Arch. 2012; 461 Suppl 1: 291-2.
- Крупнов Н.М. Структурные изменения мужских половых желез при дезоморфиновой наркомании. В: Материалы форума Мужское здоровье и долголетие, Россия. Москва; 2011. с. 50.
- Федотов А.В., Крупнов Н.М., Мазурова М.П. и соавт. Морфологические изменения мужских половых желез в различные сроки после черепно-мозговой травмы. В: Материалы V Съезда Российского общества патологоанатомов, Россия. Челябинск; 2017. с. 339.
- Miettinen M., Lasota J. KIT (CD117): a review on expression in normal and neoplastic tissues, and mutations and their clinicopathologic correlation. Appl. Immunohistochem. Mol. Morphol. 2005; 13(3): 205-20.
- Bergman M. Physiology of Spermatogenesis. In: Schill W.B., Comhaire F.N., Hargreave T.B., editors. Andrology for the clinician. 1st ed. Berlin: Springer; 2006. p. 272-81.
补充文件