Vaginal microbiocenosis in women with trichomoniasis
- Authors: Grigoryev A.N.1, Rybina E.V.1, Martikaynen Z.M.1, Savicheva A.M.1
-
Affiliations:
- D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
- Issue: Vol 65, No 4 (2016)
- Pages: 57-64
- Section: Articles
- URL: https://journals.eco-vector.com/jowd/article/view/5823
- DOI: https://doi.org/10.17816/JOWD65457-64
- ID: 5823
Cite item
Full Text
Abstract
Background. Trichomoniasis is accompanied by substantial colonization of the genital tract by various opportunistic microorganisms and reduced amount of lactobacilli. Both processes have a negative impact on the reproductive health and fetal development. Today, however, in the treatment of trichomoniasis insufficient attention is paid to the restoration of the normal vaginal microflora.
Aim. An attempt was made to assess the vaginal microbiocenosis of patients with trichomoniasis using traditional and novel molecular methods.
Matherials and Methods. Archived vaginal samples from 37 women with trichomoniasis were used, which were placed on slides, fixed in the flame and stained according the Gram method and by methylene blue and stored in boxes within last 15 years. The preparations were evaluated using microscopy and the nucleic acid amplification based test Femoflor and tests for the detection of DNA of sexually transmitted agents.
Results. According to the microscopic examination, disorders of the vaginal microbiocenosis were detected in 89.2% of patients with trichomoniasis. C. trachomatis was detected in 8.1% of the samples. Obligate anaerobic microorganisms were determined in all samples, accounting for 8% to 100% of the total bacterialthe majority of the women. Facultative anaerobic microflora was also found in all the patients. Lactobacilli were detected in 8.1% of the women, and mycoplasma – in 37.8%.
Conclusions. It was shown that in women with trichomoniasis there are often disturbances of the normal vaginal flora, manifested as the presence of a variety of opportunistic bacteria, accompanied by an inflammatory response. Almost half of the preparations showed bacterial vaginosis. Noteworthy, there was high prevalence of Mycoplasma hominis. For the first time, a technique of DNA testing in the materials placed on glass slides after prolonged storage was applied.
Full Text
Актуальность проблемы
В современной литературе имеется немало сообщений о корреляции трихомониаза и нарушений нормальной микрофлоры влагалища [1–10]. При трихомониазе отмечается выраженная колонизация половых путей женщин разнообразными условно-патогенными микроорганизмами, как анаэробными, так и аэробными, в том числе гарднереллами, бактероидами, мобилюнкусами, стафилококками, стрептококками, энтерококками, энтеробактериями, дрожжеподобными грибами рода Candida, микоплазмами и другими микроорганизмами. При этом количество лактобацилл значительно снижено. Дисбиотические процессы во влагалище в сочетании с трихомонадами оказывают негативное влияние на репродуктивное здоровье женщин, в том числе на течение беременности, а также на развитие плода и состояние новорожденного [11–15]. Симптомы и прогноз при урогенитальном трихомониазе обусловлены многими аспектами: антагонистическими и симбионтными взаимоотношениями Trichomonas vaginalis с различными микроорганизмами, формирующими индивидуальный микробиоценоз половых путей, а также влиянием защитных факторов макроорганизма. Важно отметить, что в условиях совместного существования микроорганизмов происходит изменение их видового состава и количества, а также их вирулентности на фоне микробного антагонизма и синергизма. При этом наблюдается феномен горизонтального переноса генов. В настоящее время обсуждается вопрос о частоте выявления различных микроорганизмов, населяющих биотоп совместно с трихомонадами, а также о механизме формирования таких микробиоценозов [16–20]. Следует понимать, что трихомонадная инфекция является только одним из факторов в рассматриваемом вопросе. Необходимо учитывать риск возникновения и развития дисбиотических нарушений микробиоценоза влагалища при других, в том числе сочетанных, инфекциях, передаваемых половым путем. Неудовлетворительные результаты терапии во многом определяются недостатками в схемах лечения, не учитывающих многосложные взаимодействия всех участников и условий микробиоценоза влагалища. В стратегии лечения трихомониаза помимо элиминации возбудителя важно восстановление нормальной микроэкосистемы данного биотопа. Все вышеперечисленные аспекты требуют проведения соответствующих диагностических и лечебных мероприятий, а также научных изысканий.
Традиционно для диагностики трихомониаза и общей оценки состояния микробиоценоза влагалища применяют микроскопические методы исследования нативного и окрашенного препаратов, а также культивирование микроорганизмов на питательных средах. Метод микроскопического исследования в данном случае обладает высокой специфичностью, низкими финансовыми и трудовыми затратами, приемлем для малооснащенных лабораторий. Однако он значительно уступает по чувствительности методам амплификации нуклеиновых кислот (МАНК) и требует немалой квалификации исследователя, когда нужно отличать трихомонады от других эукариотических клеточных элементов [21–28]. Для микроскопического исследования вагинального отделяемого с целью диагностики бактериального вагиноза с 1991 г. стали использовать метод Нуджента. Способ прост в использовании, не требует дополнительного оснащения, имеет три строго очерченных критерия оценки морфотипов бактерий и балльную шкалу для интерпретации результата [29]. В настоящее время метод Нуджента рассматривается как «золотой стандарт» лабораторной диагностики бактериального вагиноза. Различные модификации микроскопического метода оценки микробиоценоза влагалища, в том числе по Нудженту, совместимы друг с другом и органично дополняют друг друга.
Современные методы исследования нуклеиновых кислот [16, 17, 25, 26], в частности полимеразная цепная реакция (ПЦР) с детекцией результата в режиме реального времени (real-time), позволяют детально определить видовое разнообразие как аэробной, так и анаэробной составляющей вагинальной микрофлоры. В основе МАНК лежит энзиматическая амплификация специфических фрагментов нуклеиновых кислот микроорганизма-мишени с последующей детекцией продуктов амплификации (ампликонов). Очевидно, что за счет амплификации чувствительность этих методов значительно превышает эту характеристику других методов исследования, что позволяет выявлять малые количества нуклеиновых кислот микроорганизмов. В последние годы появляются тест-системы real-time с одновременным определением в одной реакционной смеси нескольких мишеней (формат мультиплекс-ПЦР), что значительно упрощает, технически и экономически, решение сложных диагностических задач.
Культуральный метод для диагностики трихомониаза и бактериальной, особенно анаэробной, составляющей микробиоценоза влагалища на сегодняшний день имеет существенные ограничения в сравнении с рассмотренными выше подходами [21, 22, 30].
Цель исследования
Оценка состояния микробиоценоза влагалища у пациенток с трихомониазом с использованием методов микроскопического исследования окрашенных препаратов и амплификации нуклеиновых кислот.
Материалы и методы
Клиническим материалом для исследования послужило отделяемое влагалища 37 сексуально активных женщин репродуктивного возраста с трихомониазом. Для микроскопического исследования клинический образец наносили на два предметных стекла. При наличии трихомонад стекла после удаления иммерсионного масла помещали в закрытые боксы и хранили при температуре 18–20 оC. Архивные материалы, собранные за 15 лет (2001–2015), вначале подвергали микроскопическому исследованию. После тщательной очистки стекол от иммерсионного масла скальпелем материал соскабливали и помещали в транспортную среду для МАНК для последующего выделения ДНК.
Для изучения вагинального микробиоценоза использовали метод микроскопического исследования окрашенных по Граму и метиленовым синим препаратов. Анализ проводили при увеличении светового микроскопа × 1000. Оценивали наличие лактобацилл и их количество, присутствие другой, нелактобациллярной микрофлоры, «ключевых» клеток, а также элементов дрожжеподобных грибов. Одновременно определяли соотношение лейкоцитов и эпителиальных клеток, наличие базального и парабазального эпителия для оценки воспалительной реакции. При микроскопическом исследовании применяли систему анализа изображений с программным обеспечением ВидеоТест Урогин (Санкт-Петербург). Эта система представляет собой микроскоп, оснащенный видеокамерой, и компьютер с программным обеспечением, позволяющим анализировать и сохранять в базе данных полученные изображения изучаемых препаратов и результаты обработки данных. По шкале Нуджента в баллах оценивали наличие или отсутствие, а также количество бактерий различных морфотипов (Lactobacillus, Gardnerella, Mobiluncus) и проводили интерпретацию состояния вагинального микробиоценоза: 1–3 балла — отсутствие бактериального вагиноза, 4–6 баллов — промежуточный тип вагинального микробиоценоза, 7–10 баллов — бактериальный вагиноз.
ДНК выделяли с использованием комплектов для экстракции ДНК: Проба-НК-ПЛЮС (ООО «НПО ДНК-Технология», Москва) и ДНК-сорб-АМ (ФБУН «ЦНИИ эпидемиологии Роспотребнадзора», Москва). С целью контроля сохранности нуклеиновых кислот в архивных материалах и пригодности их для исследования все полученные образцы были протестированы на наличие ДНК человека.
Для подробного определения таксономического разнообразия микроорганизмов, представляющих изучаемый микробиоценоз, использовали мультиплекс-ПЦР-тест real-time Фемофлор-16 (НПО «ДНК-Технология», Москва). Реакция ставилась на приборе ДТ-96 того же производителя. Для выявления возбудителей инфекций, передаваемых половым путем (ИППП), применяли набор реагентов того же формата для одновременного выявления ДНК Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma genitalium и Trichomonas vaginalis «АмплиСенс N. gonorrhoeae / C. Trachomatis / M. Genitalium / T. Vaginalis МУЛЬТИПРАЙМ-FL» (ФБУН «ЦНИИ эпидемиологии Роспотребнадзора», Москва). Амплификацию проводили на детектирующем амплификаторе Rotor-Gene-6000 (Corbett Research, Австрия).
Результаты исследования
Из 37 женщин с выявленными трихомонадами воспалительная реакция слизистой оболочки влагалища по данным микроскопического исследования была выявлена у 31 пациентки (83,8 %). Количество полиморфноядерных лейкоцитов по отношению к клеткам плоского эпителия у этих женщин варьировало от 2 : 1 до 19 : 1, определялись клетки базального и парабазального слоя эпителия. У 6 пациенток (16,2 %) микроскопические признаки воспаления выявлены не были. При этом «ключевые» клетки были выявлены только в 27,0 % случаев (10 из 37). Элементы дрожжеподобных грибов обнаружены у 3 женщин (8,1 %).
В исследовании по методу Нуджента отсутствие бактериального вагиноза отмечено у 4 (10,8 %) женщин. Промежуточный тип микробиоценоза влагалища выявлен у 16 (43,2 %), а бактериальный вагиноз — у 17 (46,0 %) женщин. Таким образом, нарушение вагинального микробиоценоза отмечено у 33 (89,2 %) пациенток с трихомониазом.
Состояние микробиоценоза влагалища у женщин с трихомониазом представлено в таблице 1.
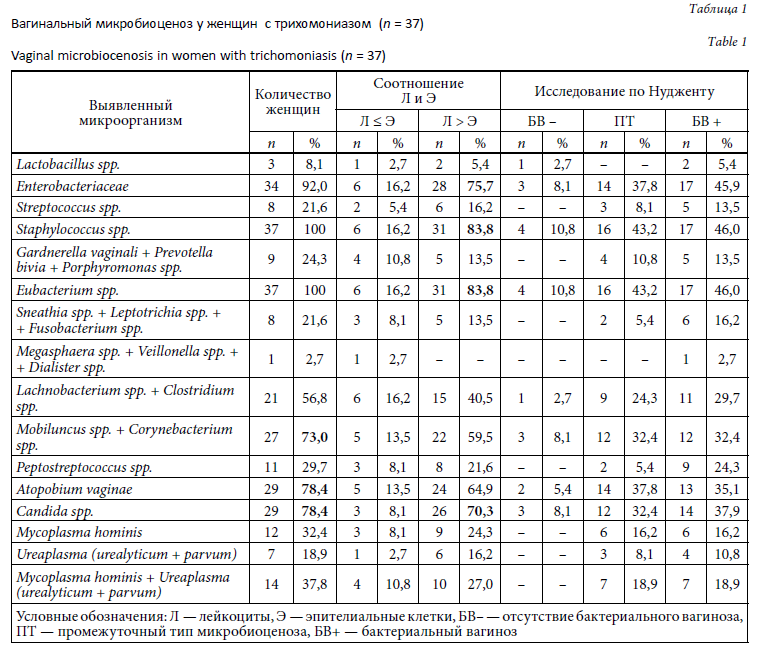
Во всех изученных образцах в МАНК было выявлено наличие ДНК человека.
По результатам тестирования системой «АмплиСенс N. Gonorrhoeae / C. Trachomatis / M. genitalium / T. Vaginalis МУЛЬТИПРАЙМ-FL» Trichomonas vaginalis обнаружены во всех клинических материалах, а Chlamydia trachomatis — в 3 (8,1 %) пробах. При одновременном выявлении трихомонад и хламидий соотношение лейкоцитов и эпителиальных клеток составило 6 : 1–10 : 1. Neisseria gonorrhoeae и Mycoplasma genitalium ни в одной пробе выявлены не были.
По данным теста Фемофлор облигатно-анаэробные микроорганизмы рода Eubacterium выявлены во всех образцах. В 3 (8,1 %) пробах эти микроорганизмы обнаружены одновременно с Atopobium vaginae. У 33 (89,2 %) женщин выявленная облигатно-анаэробная составляющая микробиоценоза влагалища была более разнообразной и составляла от 8 до 100 % бактериальной массы. Микроорганизмы группы Gardnerella vaginalis / Prevotella bivia / Porphyromonas spp. были обнаружены у 9 (24,3 %) женщин, Mobiluncus spp. / Corynebacterium spp. — в 27 (73,0 %) случаях.
По данным этого же теста факультативно-анаэробная составляющая микробиоценоза влагалища, представленная энтеробактериями, стафилококками и стрептококками, определялась у всех пациенток. При этом представители Enterobacteriaceae встречались в 34 (92,0 %) случаях, Streptococcus spp. — в 8 (21,6 %), Staphylococcus spp. — в 37 (100 %).
Mycoplasma hominis выявлены тестом Фемофлор у 12 (32,4 %) пациенток, Ureaplasma spp. — у 7 (18,9 %). Candida spp. определялись у 29 (78,4 %) женщин.
Обсуждение
Нами впервые была апробирована возможность использования соскобов с длительно хранившихся фиксированных и окрашенных предметных стекол для исследования клинических материалов в МАНК. Принципиальную возможность применения такой методики подтверждает сохранность во всех исследованных материалах ДНК человека и Trichomonas vaginalis. Очевидно, что оценка возможностей такого подхода в дальнейшем потребует более детальных научных изысканий с количественной характеристикой динамики сохранности нуклеиновых кислот в зависимости от условий и сроков хранения образцов.
Полученные данные показали, что трихомониаз может сопровождаться разными состояниями вагинального микробиоценоза, при этом чаще имеет место нарушение нормальной микрофлоры, которое, как правило, сопровождается воспалительной реакцией слизистой влагалища и обнаружением значительного разнообразия условно-патогенной и патогенной микрофлоры. Было продемонстрировано, что у пациенток с трихомониазом хламидии, микоплазмы, уреаплазмы и дрожжеподобные грибы чаще обнаруживали при промежуточном типе вагинального микробиоценоза или при бактериальном вагинозе.
По данным метода Нуджента почти у половины обследованных пациенток развивался бактериальный вагиноз, при котором доминирующая естественная микрофлора вытеснялась 100–1000-кратным повышенным количеством анаэробных бактерий. В целом нарушение вагинального микробиоценоза отмечено почти у 90 % пациенток, при этом у подавляющего большинства женщин присутствуют бактерии морфотипа Gardnerella. Подобные факты отражены в работах ряда зарубежных исследователей [3, 7, 31–34].
На фоне трихомониаза выявлено снижение частоты обнаружения лактобацилл и увеличение частоты обнаружения условно-патогенной микрофлоры в количествах, нехарактерных для микробиоценоза влагалища здоровых женщин. Это согласуется с данными других авторов [9, 35, 36]. Подобные изменения отражают снижение колонизационной резистентности биотопа и имеют связь с состоянием лактофлоры [37]. Уменьшение частоты обнаружения лактобацилл, обладающих антагонистической активностью к потенциальным патогенам, объясняет увеличение видового разнообразия микроорганизмов и значительный процент бактериального вагиноза. В последнее время это состояние чаще описывается как полибактериальный дисбиоз, степень которого хорошо коррелирует с исследованием по методу Нуджента [38]. Показано, что оптимальные условия для роста анаэробных микроорганизмов, изменения микроэкологического статуса влагалища, снижения и исчезновения лактобацилл возникают при различных состояниях, но особенно характерны для трихомонадной инфекции [31]. Рядом авторов отмечается выраженная корреляция трихомониаза с промежуточным типом микробиоценоза влагалища и уникальность формирующегося при этой инфекции микробного пейзажа. Выдвинута гипотеза о роли Trichomonas vaginalis в формировании таких микробиоценозов, которые способствуют выживанию возбудителя и его передаче половому партнеру [34].
Выявлено также значительное превышение над популяционным уровнем распространенности микоплазм, особенно Mycoplasma hominis, обнаруженных у трети пациенток. Последний факт интересен в свете недавних исследований ассоциаций микоплазм, в том числе малоизученных, с трихомонадами [9, 34, 39]. В них показана высокая корреляция обнаружения Trichomonas vaginalis совместно с этими микроорганизмами, а также особенности метаболизма и вирулентности последних. Очевидна необходимость обследования пациенток с трихомониазом на микоплазмы и дальнейших научных исследований.
Таким образом, в целом при трихомониазе обнаружены значительные нарушения микробиоценоза влагалища как в аэробной, так и в анаэробной составляющей. С возрастанием частоты выявления патогенной и условно-патогенной микрофлоры отмечено снижение встречаемости нормального состояния микробиоты, что может иметь дополнительное или самостоятельное патогенетическое значение в развитии воспалительных заболеваний. С высокой частотой присутствуют хламидии, микоплазмы, уреаплазмы, дрожжеподобные грибы, дополнительно усугубляющие состояние вагинальной микробиоты.
Необходимы дополнительные исследования по оценке микробиоценоза влагалища женщин с трихомониазом. Актуальными остаются дальнейшая разработка тестов на основе МАНК и их применение для получения новых знаний. Несмотря на то что эти методы значительно расширили представления о составе вагинальной микробиоты и ее динамическом характере [40], большая часть знания о ней все еще основана на культуральном методе. Тем не менее представления о микробиоте человека до сих пор остаются неполными, что демонстрируется увеличением доли обнаруживаемых некультивируемых микроорганизмов и ограниченным перечнем тех, которые выявляются культурально. Следующим этапом исследований должно стать выяснение конкретных функций всех участников микробиоценоза влагалища в его поддержании и развитии. Ценную информацию должны принести работы по видовой идентификации лактобацилл [38, 41], которые выявляются в различных типах микробиоценоза при трихомониазе. Эти знания расширят понимание проблемы и позволят выработать более эффективные стратегии ведения больных.
Заключение
Трихомониаз, выявленный у сексуально активных женщин репродуктивного возраста, часто коррелирует с нарушениями вагинального микробиоценоза. Этот факт со сравнимой частотой отмечен как при микроскопическом, так и при молекулярно-биологическом исследовании отделяемого влагалища. Однако показатели, определяемые разными методами, могут отличаться в значимых пределах, что необходимо учитывать при выборе методов обследования.
Таким образом, результаты работы подтвердили необходимость комплексного лабораторного обследования пациенток с трихомониазом.
Целесообразно применение оптимального набора различных методов исследования для выявления полной картины заболевания и назначения адекватного лечения. Возможные перспективы в этом отношении открывает апробированная методика использования МАНК для анализа архивного клинического материала, нанесенного на предметные стекла.
About the authors
Aleksey N. Grigoryev
D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
Author for correspondence.
Email: iagmail@ott.ru
Researcher, Laboratory of microbiology Russian Federation
Elena V. Rybina
D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
Email: iagmail@ott.ru
Bacteriologist, Laboratory of microbiology Russian Federation
Zinaida M. Martikaynen
D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
Email: iagmail@ott.ru
PhD, Senior Researcher, Laboratory of microbiology Russian Federation
Alevtina M. Savicheva
D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS
Email: savitcheva@mail.ru
MD, Professor, Head of Laboratory of Microbiology Russian Federation
References
- Nijhawan AE, DeLong AK, Celentano DD, et al. The association between trichomonas infection and incarceration in HIV-seropositive and at-risk HIV-seronegative women. Sex Transm Dis.2011;38(12):1094-1100. doi: 10.1097/OLQ.0b013e31822ea147.
- Schwebke JR, Burgess D. Trichomoniasis. Clin Microbiol Rev. 2004;17(4):794-803. doi: 10.1128/CMR.17.4.
- -803.2004.
- Zaki MElS, Raafat D, Emshaty WEl, et al. Correlation of Trichomonas vaginalis to bacterial vaginosis: a laboratory-based study. J Infect Dev Ctries. 2010;4 (3):156-163. doi: 10.3855/jidc.434.
- Rathod SD, Krupp K, Klausner JD, et al. Bacterial vaginosis and risk for Trichomonas vaginalis infection: a longitudinal analysis. Sex Transm Dis. 2011;38(9):882-886. doi: 10.1097/OLQ.0b013e31821f91a1.
- Street DA, Wells C, Taylor-Robinson D, Ackers JP.
- Interaction between Trichomonas vaginalis and other pathogenic micro-organisms of the human genital tract.
- Br J Vener Dis. 1984;60:31-38. doi: 10.1136/sti.60.1.31.
- Gatski M, Martin DH, Clark RA, et al. Co-occurrence of Trichomonas vaginalis and bacterial vaginosis among HIV-positive women. Sex Transm Dis. 2011;38(3):163-166. doi: 10.1097/OLQ.0b013e3181f22f56.
- Allsworth JE, Ratner JA, Peipert JF. Trichomoniasis and
- other sexually transmitted infections: results from the
- –2004 NHANES surveys. Sex Transm Dis. 2009;
- (12):738-744. doi: 10.1097/OLQ.0b013e3181b38a4b.
- Ginocchio CC, Chapin K, Smith JS, et al. Prevalence of Trichomonas vaginalis and coinfection with Chlamydia trachomatis and Neisseria gonorrhoeae in the United States as determined by the Aptima Trichomonas vaginalis nucleic acid amplification assay. J Clin Microbiol. 2012;50(8):2601-2608. doi.org/10.1128/JCM.00748-12.
- Conrad MD, Bradic M, Warring SD, et al. Getting trichy: tools and approaches to interrogating Trichomonas vaginalis in a post-genome world. Trends Parasitol. 2013;29(1):17-25. doi: 10.1016/j.pt.2012.10.004.
- Kissinger P. Trichomonas vaginalis: a review of epidemiologic, clinical and treatment issues. BMC Infect Dis. 2015;15:307. doi: 10.1186/s12879-015-1055-0.
- Petrin D, Delgaty K, Bhatt R, Garber G. Clinical and microbiological aspects of Trichomonas vaginalis. Clin Microbiol Rev. 1998;11(2):300-317.
- Hardy PH, Hardy JB, Nell EE, et al. Prevalence of six sexually transmitted disease agents among pregnant inner-city adolescents and pregnancy outcome. Lancet. 1984;2:333-337. doi: 10.1016/S0140-6736(84)92698-9.
- Cotch MF, Pastorek JG, Nugent RP, et al. Trichomonas vaginalis associated with low birth weight and preterm delivery. The vaginal infections and prematurity study group. Sex Transm Dis. 1997;24:353-360. doi: 10.1097/00007435-199707000-00008.
- Ness RB, Kip KE, Hillier SL, et al. A cluster analisis of bacterial vaginosis-associated microflora and pelvic inflammatory disease. Am J Epidemiol. 2005;162(6):585-590. doi: 10.1093/aje/kwi243.
- Martin DH. The microbiota of the vagina and its influence on women’s health and disease. Am J Med Sci. 2012;343(1):2-9. doi: 10.1097/MAJ.
- b013e31823ea228.
- McIver CJ, Rismanto N, Smith C, et al. Multiplex PCR testing detection of higher-than-expected rates of cervical Mycoplasma, Ureaplasma, and Trichomonas and viral agent infections in sexually active australian women. J Clin Microbiol. 2009;47(5):1358-1363. doi: 10.1128/JCM.01873-08.
- McKechnie ML, Hillman R, Couldwell D, et al. Simultaneous identification of 14 genital microorganisms in urine by use of a multiplex PCR-based reverse line blot assay. J Clin Microbiol.2009;47(6):1871-1877. doi: 10.1128/JCM.00120-09.
- Zhou X, Bent SJ, Schneider MG, et al. Characterization of vaginal microbial communities in adult healthy women using cultivation-independent methods. Microbiology. 2004;150(8):2565-2573. doi: 10.1099/mic.0.26905-0.
- Bartlett JG, Onderdonk AB, Drude E, et al. Quantitative bacteriology of the vaginal flora. J Infect Dis. 1977;136(2):271-277. doi: 10.1093/infdis/136.2.271.
- Oakley BB, Fiedler TL, Marrazzo JM, Fredricks DN. Diversity of human vaginal bacterial communities and associations with clinically defined bacterial vaginosis. Appl Environ Microbiol.2008;74(15):4898-4909. doi: 10.1128/AEM.02884-07.
- Мартикайнен З.М., Григорьев А.Н., Рыжкова О.С., и др. Сравнение лабораторных методов диагностики инфекций, вызываемых Trichomonas vaginalis // Журнал акушерства и женских болезней. — 2014. — Т. LXIII. — № 1 . — С. 5–9. [Martikaynen ZM, Grigoryev AN, Ryzhkova JS, et al. Comparison of laboratory methods for diagnosis of Trichomonas vaginalis. Journal of Obstetrics and Women’s Diseases. 2014; LXIII(1):5-9. (In Russ).]
- Григорьев А.Н. Современное состояние проблемы лабораторной диагностики урогенитального трихомониаза // Журнал акушерства и женских болезней. — 2013. — Т. LXII. — № 1. — С. 32–41. [Grigoryev AN. Current state of the problem of the laboratory diagnostics of urogenital trichomoniasis. Journal of Obstetrics and Women’s Diseases. 2013; LXII(1):32-41. (In Russ).]
- Гущин А.Е., Рыжих П.Г., Махлай Н.С. Сравнение пределов обнаружения микроскопии, культурального посева и методов амплификации нуклеиновых кислот, используемых в лабораторной практике для выявления Trichomonas vaginalis // Клиническая дерматология и венерология. — 2012. — № 3. — С. 16–21. [Gushin AE, Ryzhih PG, Makhlaĭ NS. Comparison of detection limits of microscopy, culture, and nucleic acid amplification techniques using in the laboratory practice for the identification of Trichomonas vaginalis. Klinicheskaja dermatologija i venerologija. 2012;3:16-21. (In Russ).]
- Шипицына Е.В., Золотоверхая Е.А., Григорьев А.Н., и др. Оценка методов амплификации нуклеиновых кислот для диагностики трихомониаза // Журнал акушерства и женских болезней. — 2011. — Т. LX. — № 2. — С. 73–79. [Shipitsyna YeV, Zolotoverhaja YeF, Grigoryev AN, et al. Assessment of methods of amplification of nucleic asids for diagnostics of trichomoniasis. Journal of Obstetrics and Women’s Diseases. 2011; LX(2):73-79. (In Russ).]
- Pillay A, Radebe F, Fehler G, et al. Comparison of a TaqMan-based real-time polymerase chain reaction with conventional tests for the detection of Trichomonas vaginalis. Sex Transm Infect.2007;83:126-129. doi: 10.1136/sti.2006.022376.
- Nye MB, Schwebke JR, Body BA. Comparison of APTIMA Trichomonas vaginalis transcription-mediated amplification to wet mount microscopy, culture, and polymerase chain reaction for diagnosis of trichomoniasis in men and women. Am J Obstet Gynecol. 2009;200(2):188.e1-188.e7. doi: 10.1016/j.ajog.2008.10.005.
- Simpson P, Higgins G, Qiao M, et al. Real-time PCRs for detection of Trichomonas vaginalis beta-tubulin and 18S rRNA genes in female genital specimens. J Med Microbiol. 2007;56: 772-777. doi: 10.1099/jmm.0.47163-0.
- Schirm J, Bos PA, Roozeboom-Roelfsema IK, et al. Trichomonas vaginalis detection using real-time TaqMan PCR. J Microbiol Methods. 2007;68:243-247. doi: 10.1016/j.mimet.2006.08.002.
- Nugent RP, Krohn MA, Hillier SL. Reliability of diagnosing bacterial vaginosis in improved by a standardized method of gram stain interpretation. J Clin Microbiol. 1991;29(2):297-301.
- Рыбина Е.В. Современные методы оценки микробиоценоза влагалища // Журнал акушерства и женских болезней. — 2015. — Т. LXIV. — № 1. — С. 53–66.
- [Rybina EV. Current methods for evaluation of the vaginal microbiocenosis. Journal of Obstetrics and Women’s Diseases. 2015; LXIV(1):53-66. (In Russ).]
- Brotman RM, Bradford LL, Conrad M, et al. Association between Trichomonas vaginalis and vaginal bacterial community composition among reproductive-age women. Sex Transm Dis. 2012;39(10):807-812. doi: 10.1097/OLQ.0b013e3182631c79.
- Brotman RM, Klebanoff MA, Nansel TR, et al. Bacterial vaginosis assessed by gram stain and diminished colonization resistance to incident gonococcal, chlamydial, and trichomonal genital infection. J Infect Dis. 2010;202(12):1907-1915. doi: 10.1086/657320.
- Balkus JE, Richardson BA, Rabe LK, et al. Bacterial vaginosis and the risk of Trichomonas vaginalis acquisition among HIV-1 negative women. Sex Transm Dis. 2014;41(2):
- -128. doi: 10.1097/OLQ.0000000000000075.
- Martin DH, Zozaya M, Lillis RA, et al. Unique vaginal microbiota that includes an unknown Mycoplasma-like organism is associated with Trichomonas vaginalis infection. J Infect Dis.2013;207(12):1922-1931. doi: 10.1093/infdis/jit100.
- Amsel R, Totten PA, Spiegel CA, et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiological associations. Am J Med. 1983;74:14-22. doi: 10.1016/0002-9343(83)91112-9.
- Demirezen S, Korkmas E, Beksa MS. Association between trichomoniasis and bacterial vaginosis: examination of 600 cervicovaginal smears. Cent Eur J Pablic Health. 2005;13(2):96-99.
- Sharma H, Tal R, Clark NA, Segars JH. Microbiota and pelvic inflammatory disease. Semin Reprod Med. 2014;32(1):43-49. doi: 10.1055/s-0033-1361822.
- Wijgert J, Borgdorff H, Verhelst R, et al. The vaginal microbiota: what have we learned after a decade of molecular characterization? PLoS One. 2014;9(8): e105998. doi: 10.1371/journal.pone.0105998.
- Fettweis JM, Serrano MG, Huang B, et al. An emerging mycoplasma associated with trichomoniasis, vaginal infection and disease. PLoS One. 2014;9(10): e110943. doi: 10.1371/journal.pone.0110943.
- Verhelst R, Verstraelen H, Claeys G, et al. Cloning of 16S rRNA genes amplified from normal and disturbed vaginal microflora suggests a strong association between Atopobium vaginae, Gardnerellavaginalis and bacterial vaginosis. BMC Microbiol. 2004;4:16. doi: 10.1186/1471-2180-4-16.
- Pavlova SI, Kilic AO, Kilic SS, et al. Genetic diversity of vaginal lactobacilli from women in different countries based on 16S rRNA gene sequences. J Appl Microbiol. 2002;92(3):451-459. doi: 10.1046/j.1365-2672.2002.01547.x.
Supplementary files








