Pathogenic Variants of Urolithiasis
- Authors: Baketin P.S1, Mollaev R.A2, Mazurenko D.A3, Grigoryev V.E1, Gadzhiev N.K1, Obidnyak V.M4, Pisarev A.V5, Tagirov N.S6, Malkhasyan V.A7, Petrov S.B1, Popov S.V1
-
Affiliations:
- A.M. Nikiforov Russian Center of Emergency and Radiation Medicine
- Askerkhanov Central municipal hospital
- Urologic Clinic. EMC
- St Petersburg St Luka Clinical Hospital
- St Petersburg Multiprofile Center
- St Petersburg St Elisabeth City Hospital
- Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
- Issue: Vol 8, No 1 (2017)
- Pages: 95-105
- Section: Articles
- URL: https://journals.eco-vector.com/pediatr/article/view/6122
- DOI: https://doi.org/10.17816/PED8195-105
- ID: 6122
Cite item
Full Text
Abstract
Full Text
Введение
Неуклонное увеличение распространенности мочекаменной болезни определяет актуальность исследований, посвященных изучению патогенеза этого заболевания [1, 2]. К сожалению, не выработана единая патогенетическая концепция, способная обосновать появление камней у всех фенотипов камнеобразователей [3]. К счастью, с увеличением количества работ, посвященных патогенезу камнеобразования, а также на основании данных послеоперационного наблюдения за камнеобразователями появилась возможность категоризировать патогенетические варианты мочекаменной болезни. Ниже представлены четыре основных механизма, охватывающих или объясняющих камнеобразование как таковое:
- рост конкрементов над «белыми» интерстициальными гидроксиапатитными бляшками, или бляшками Рэндалла [7, 10, 11, 22];
- образование конкрементов над заглушками протоков Беллини (ПБ) [8, 25, 26];
- образование микролитов в собирательных канальцах внутреннего мозгового вещества почки [11];
- образование конкрементов в свободном растворе в чашечно-лоханочной системе [11, 19].
Пониманию вышеописанных механизмов камнеобразования значительно способствовали исследования in vivo (животные модели и т. д.) и химико-физические модели в растворе in vitro (кинетика кристаллизации и характер ингибирования камнеобразования). Подробно рассмотрим каждый из вышеописанных механизмов.
Образование конкрементов на бляшках Рэндалла
Во время эндоскопического удаления камня почки достаточно часто можно видеть камни, растущие на бляшках в области сосочков чашечек (рис. 1).
В 1937 г. Рэндалл [23] впервые продемонстрировал на трупах, а современная урология с помощью эндоскопической оптики подтвердила наличие «каменных» островков на сосочках, остающихся после удаления прикрепленных к ним камней, состоящих из гидроксиапатита (ГА). Посредством интраоперационных эндоскопических снимков [20] и микрокомпьютерной томографии можно воссоздать точную локализацию конкремента на бляшке, с которой он был удален, и показать, что большинство конкрементов действительно росли, прикрепляясь к бляшкам. Высокую вероятность «бляшечного» происхождения также имеют и камни свободно лежащие в полостной системе почки [21].
На фоне всех пациентов с мочекаменной болезнью явно выделяется фенотип больных, у которых формирование кальцийоксалатных конкрементов происходит без каких-либо системных заболеваний, способных прямо влиять на их возникновение; такие больные определены в группу с идиопатическим кальцийоксалатным нефролитиазом [5, 6]. У большинства из них можно проследить семейный и/или генетический характер наследования идиопатической гиперкальциурии. При этом кальцийоксалатные конкременты у этой группы пациентов образуются в основном на бляшках (см. рис. 1).

Рис. 1. Прикрепленные к бляшкам Рэндалла конкременты у идиопатических кальцийоксалатных (CaOx) камнеобразователей: а) эндоскопический вид камня CaOx, прикрепленного к верхушке почечного сосочка (на снимке отмечено стрелкой). Бляшки Рэндалла вокруг прикрепленных конкрементов (треугольники); б ) сосочек после удаления камня. На вставке видна папиллярная поверхность того же камня. Небольшой участок белесоватого материала на камне — гидроксиапатит, при этом сам камень на сто процентов кальцийоксалатный (отмечено звездочкой)
Говоря о непосредственном механизме формирования камня согласно «бляшечному» механизму, необходимо отметить, что ранняя стадия формирования бляшек берет начало на базальной мембране тонкого нисходящего сегмента петли Генле с формирования микросферулитов (с или без включения кристаллов ГА) [10], где они сливаются и формируют единый матрикс, в котором кристаллы гидроксиапатита располагаются в виде изолированных «островков». На следующем этапе формирования бляшки последняя, увеличиваясь в размерах между канальцами и сосудами, примыкает к сосочковому эпителию.
Это те самые «белые бляшки», которые можно увидеть во время эндоскопической операции. При этом подобные бляшки за счет особенности уротелия могут пролобировать в полостную систему почки и быть подвержены воздействию мочи (рис. 2). При этом речь идет об экспозиции мочой не кристаллов гидроксиапатита, но матрикса, в котором они находятся. Особенности обрастания камнем бляшки можно видеть, если получить мелкий камень с его тканевой основой (рис. 3) [12]. Зона нарастания камня на бляшке с самим камнем демонстрируют расхождение уротелия и отделение некоторых бляшек от ткани у основания камня. При визуализации бляшки методом трансмиссионной электронной микроскопии в нижнем правом углу заметны белые очажки гидроксиапатита внутри «бляшечного» матрикса. Сама бляшка окаймлена мантией из разрушенного матрикса и кристаллов гидроксиапатита.

Рис. 2. Образование бляшек Рэндалла: а) гистологические препараты, демонстрирующие формирование бляшек Рэндалла (начальный этап). Стрелками указаны интерстициальные депозиты на базальной мембране тонкой петли Генле у почечного сосочка; б–д) трансмиссионная электронная микроскопия интерстициальных депозитов: множественные микросферулиты из чередующихся слоев матрикса с содержанием кристаллов и без. Единичные депозиты могуть быть размерами до 50 нм. Светлые слои в сферулах отражают кристаллический материал, темные слои — матрикс; е) наибольшая концентрация кристаллических депозитов определяется вокруг петель Генле (двойные стрелки); ж) распространение кристаллических депозитов в близлежащее интерстициальное пространство, вплоть до уротелия чашечек. Нарушение уротелиального слоя с локусами интерстициальных отложений, контактирующих с мочой, приводит к разрастаниям, минерализации и камнеобразованию
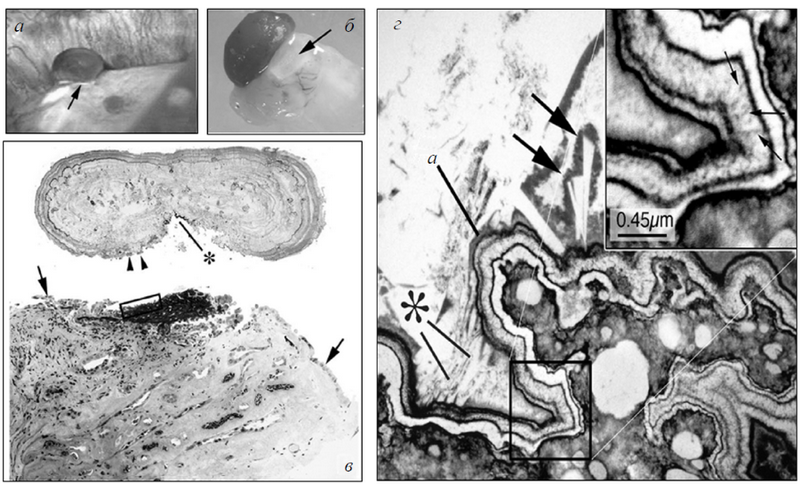
Рис. 3. Ультраструктурные особенности мест прикрепления конкрементов в почках у пациентов с идиопатическими кальцийоксалатными конкрементами: а) эндоскопический вид конкремента размером 0,5 мм, прикрепленного к верхушке почечного сосочка на бляшке Рэндалла (стрелка); б) биоптат того же конкремента с подлежащими тканями; в) тот же комплекс ткань — конкремент после деминерализации. Обратите внимание, что конкремент отделен от подлежащей ткани (прямоугольник). Часть ткани все еще осталась в камне (звездочка), двойными стрелками обозначен клеточный детрит. Одной стрелкой указаны участки сохранившегося уротелия на почечных сосочках; г) бляшки Рэндалла (внизу справа), покрытые многослойными лентообразными структурами, состоящими из кристаллов и матрикса (вставка вверху справа). В очаге а определяются небольшие (звездочка) и крупные (стрелки) кристаллы, погруженные в мочу
Самый глубокий слой матрикса (вставка в верхнем правом углу) содержит протеины Тамма – Хорсфалла — свидетельство того, что матрикс бляшки изначально был покрыт органическим матриксом мочевого происхождения [12], так как интерстициальный матрикс в норме не имеет доступа к протеинам Тамма – Хорсфалла [17]. Как будто повторяя за частицами бляшек, кристаллы гидроксиапатита нуклеируют в чередующихся слоях матрикса — некоторые свободны от кристаллов, некоторые нет. На границе с мочой кристаллы смещаются в полость чашек и формируют основу-островок для будущего камня.
Начальные ядра (микросферулиты) бляшек формируют в коллагене три типа базальной мембраны тонкого сегмента петли Генле. Опыты на животных продемонстрировали, что жидкость, содержащаяся в просвете тонкого сегмента петли, перенасыщена фосфатом кальция в виде брушита. Несмотря на отсутствие информации по ионному составу интерстиция, эпителий тонкого сегмента практически непроницаем для кальция [18]. Но при идиопатической гиперкальциурии, проявляющейся повышенным поступлением кальция из проксимальных канальцев [2], а также после еды, так называемая постпрандиальная гиперкальциурия [28], пересыщение фосфатом кальция интратубулярной жидкости может наблюдаться в течение всего дня, что в свою очередь может создавать предпосылки для формирования кристаллсодержащих микросферул и образования бляшки Рэндалла. Пока сосочковый эпителий остается интактным, бляшка защищена от воздействия мочи, но как только возникают повреждения и контакт с мочей, появляются предпосылки для нуклеации, что составляет основу для разрастания будущего камня. Схематическая последовательность формирования бляшки Рэндалла и камня над ней отображена на рис. 4.
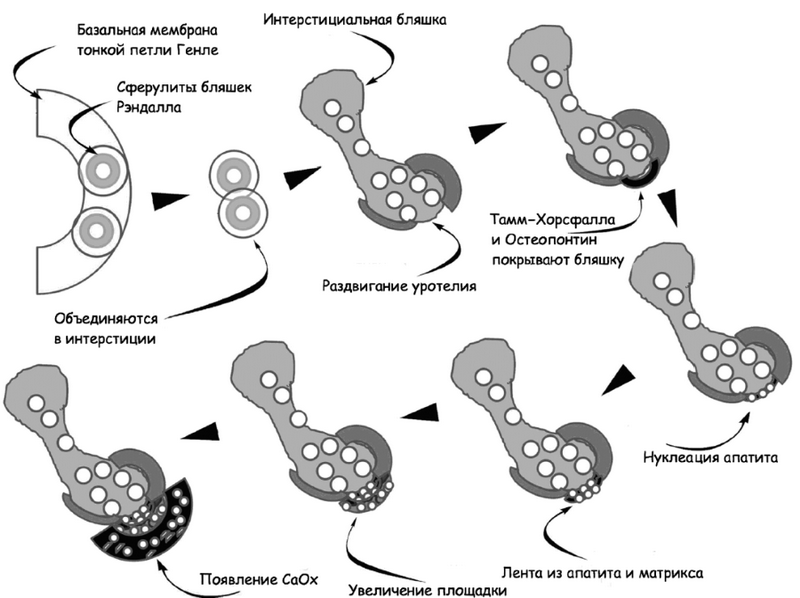
Рис. 4. Схематическая последовательность формирования камня на бляшке Рэндалла
На сегодняшний день остается немало важных вопросов: образуются ли частицы непосредственно на базальной мембране коллагена 3-го типа, и если так, то где именно на молекуле? Реагирует ли клетки тонкого сегмента петли Генле на присутствие частиц в базальной мембране через экспрессию новых белков? Какие факторы могут привести к нарушению уротелиального барьера? Самым загадочным все же остается процеcc перехода нуклеации от гидроксиапатита в кальций оксалат. Возможно, причина в изменении рН, который меняется в пределах матрикса по мере его отдаления от тканей. Возможно изменяется и сам матрикс. Почему воообще появляется CaOx? Почему, как правило, начальный ГА не прогреccирует до ГА конкрементов? Хотя разрастание на бляшке возникает и у людей, у которых образуются брушитные или ГА-конкременты [4, 16], их фенотипы все же отличаются от идиопатических кальцийоксалатных камнеобразователей, при этом процесс образования камней у них существенно отличается, так же как и нарастание CaOx возможно на бляшках и у пациентов с первичным гиперпаратиреозом, после илеостомии и с резецированной тонкой кишкой [13–15].
Пациенты с такими системными заболеваниями не имеют семейной предрасположенности к мочекаменной болезни (МКБ) в отличие от пациентов с идиопатическим кальцийоксалатным камнеобразованием, пациентов с идиопатическими брушитными (БР) и ГА-конкрементами. Различия в составе бляшек, матриксе и прочих деталях, возможно, могли бы дать объяснение.
Закупорка протоков Беллини
Не редко у пациентов с МКБ встречается закупорка протоков Беллини (ПБ), но роль этого явления в качестве источника конкрементов еще не доказана. Естественно предположить, что область этих «пробок», постоянно контактирующая с мочой с высоким насыщением CaOx и кальцием фосфата (СаР), будет в значительной степени способствовать нуклеации ГА и СаОх, становясь основой зарождающихся конкрементов [22], которые впоследствии отсоединятся и превратятся в клинически значимые камни, подлежащие удалению. Столь привлекательная формулировка, к сожалению, имеет довольно скудные доказательства. Хирурги видят заглушки Беллини как дилатированные и заполненные кристаллами протоки Беллини. Иногда кристаллы растут над заглушками в просвет чашечно-лоханочной системы (рис. 5 а, б).
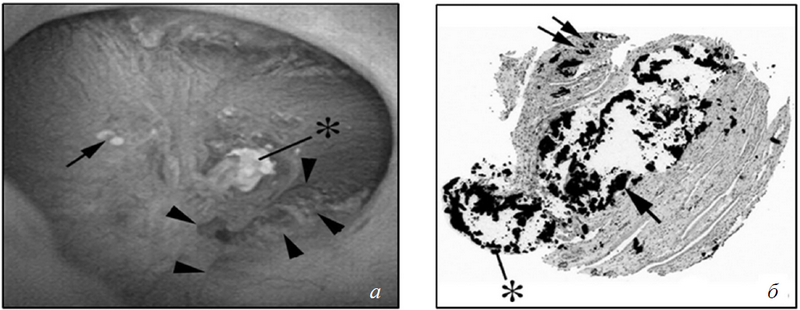
Рис. 5. Вид заглушек Беллини у пациентов с брушитными конкрементами: а) эндоскопический вид почечного сосочка. Можно видеть впячивания (треугольники) на сосочке, чего не бывает у пациентов с CaOx-конкрементами. Как и у пациентов с CaOx-камнями, на почечных сосочках пациентов с брушитными конкрементами также могут визуализироваться бляшки Рэндалла (стрелка), хоть и в меньшем количестве. На сосочках заметны отложения кристаллов желтоватого цвета в области отверстий протоков Беллини (звездочка). Эти протоки, как правило, расширены и иногда наполнены кристаллами, которые выступают за пределы протоков и могут рассматриваться как основа для прикрепления конкрементов; б) биоптат кристаллических отложений в почечных сосочках (окраска по методу Ясуэ). Стрелками отмечены отложения кристаллов в просвете собирательных канальцев мозгового вещества рядом с петлей Генле. Кристаллические отложения значительно расширяют просвет этих канальцев и индуцируют повреждения клеток вплоть до обширного некроза. Вокруг мест интралюминальных отложений определяются воспаление и интерстициальных фиброз
У пациентов с ГА- и БР-конкрементами наблюдаются округлые разрастания на местах закупоривания — обычно около 1–2 мм (рис. 6, а–д). Такие разрастания в дальнейшем могут отрываться и увеличиваться в почечных чашках до 3 мм и более. С помощью высокоразрешающих микро-КТ-изображений (см. рис. 6) было доказано, что у ГА-пациентов эти «пробки» и разрастания состоят из ГА (см. рис. 6, а, б), в то время как у БР-пациентов базис конкрементов может содержать СаОх, БР и ГА с тонким поверхностным слоем CaOx (см. рис. 6, в, г). Поэтому вполне закономерно было бы предположить, что ГА- и БР-конкременты появляются на «заглушках», однако доказательств этому на сегодняшний день нет.
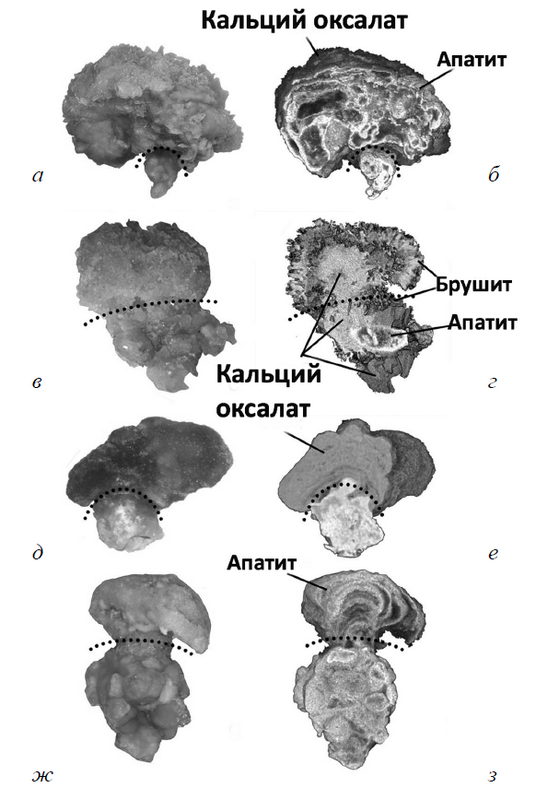
Рис. 6. Снимки заглушек Беллини: а, в, д, ж) световая микроскопия с участками разрастаний у пациентов с апатитными, брушитными конкрементами, после илеостомии и с первичным гиперпаратиреозом соответственно; б, г, е, з) микро-КТ в 3D-формате представленных камней. Пунктирная линия разграничивает заглушки и разрастания. Состав заглушек у пациентов с апатитными (а, б) конкрементами и с первичным гиперпаратиреозом (ж, з) целиком состоит из апатита. Заглушки у пациентов с брушитными камнями (в, г) представляют собой смесь брушита, апатита и CaOx, в то время как у пациентов с илеостомией (д, е) — из апатита и уратов. Разрастания у пациентов с апатитным камнеобразованием и пациентов с первичным гипертиреозом состоят преимущественно из концентрических слоев апатита, полностью из CaOx — у пациентов с илеостомами и смесью CaOx и брушита — у пациентов с брушитным камнеобразованием
Возникает естественный вопрос: как же определить, что камень возник именно как разрастание над заглушкой Беллини? Один из способов доказать этот тезис — показать, что конкремент, прикрепленный к сосочку, прикреплен не к белой бляшке, а к заглушке Беллини. Это можно видеть во время операции, когда хорошо видны поля прикрепления конкрементов к дилатированным протокам Беллини. Кроме того, на удаленных камнях в области прикрепления должны остаться следы заглушек.
Механизмы разрастаний на заглушках
Одним из малоизученных на сегодняшний день остается вопрос разрастаний на заглушках, несмотря на признание Рэндаллом наличия этого процесса [24]. Факторы, контролирующие разрастание заглушек Беллини, следующие: состав заглушек, значения сверхнасыщения мочи камнеобразующими соединениями, а также молекулы мочи, осаждающиеся над заглушками и создающие матрикс для последующего разрастания. Что это за молекулы, пока неизвестно. Но работы в этом направлении ведутся.
Для объяснения состава заглушек и состава разрастаний самого по себе сверхнасыщения камнеобразующих соединений явно не достаточно. Например, пациенты с БР- и ГА-камнеобразованием имеют высокие показатели сатурации CaР в моче, однако заглушки у пациентов с БР-камнеобразованием состоят из БР, СаОх и ГА, в то время как у группы с ГА-камнеобразованием — только из ГА. В то же время разрастания на заглушках из БР — это брушит и CaOx, а на заглушках из ГА — это ГА.
Повреждение сосочков
Генез конкрементов предполагает, помимо закупорки ПБ, сопутствующие повреждения сосочков. Процесс повреждения сосочка заглушками очевиден. Этот процесс затрагивает эпителий канальцев, вплоть до полного его уничтожения, так что кристаллы прикрепляются непосредственно к базальной мембране канальцев; сами протоки при этом могут дилатироваться до 20-кратного размера. Вокруг заглушек заметны фиброз и экспрессия гиалуроновой кислоты — как признак повреждения, даже в эпителии незначительно вовлеченных канальцах, а иногда и в эпителии нормальных канальцев, расположенных рядом [27]. У некоторых пациентов закупорка распространяется и во внутренние медуллярные собирательные канальцы (ВМСК). Заглушки ВМСК выглядят как желтые цилиндры или желтые бляшки.
Повреждение коркового вещества
В корковом веществе пациентов группы идиопатических камнеобразователей патологии практически не выявлено (рис. 7), в то время как у пациентов с ГА- и БР-конкрементами часто имеет место фиброз, который может быть следствием заглушек. При этом повреждение коркового вещества находят у всех пациентов с заглушками Беллини. Механизмы повреждения остаются неясными.
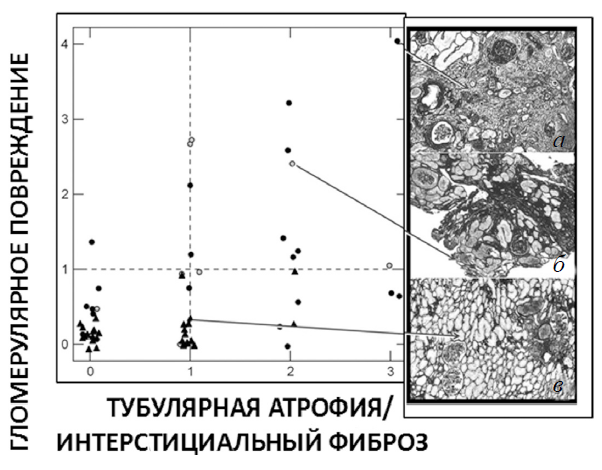
Рис. 7. Кортикальный интерстициальный фиброз, атрофия канальцев и гломерулосклероз у пациентов с брушитными камнями (черные круги), с апатитными камнями (светлые кружки) и у пациентов с идиопатическими кальцийоксалатными камнями (черные треугольники): из 30 кортикальных биоптатов только у 2 пациентов с идиопатическими кальцийоксалатными камнями зафиксированы интерстициальные изменения по шкале выше 1 балла, и не выявлено ни одного случая тяжелого гломерулярного поражения выше 1 балла, значительные кортикальные повреждения зафиксированы у 4 из 11 пациентов с апатитными конкрементами и у 12 из 25 пациентов с брушитными конкрементами
Механизмы закупорки протоков Беллини и внутренних медуллярных собирательных канальцев
Механизм формирования заглушек протоков Беллини до сих пор не определен. Возможно, сверхнасыщение стимулирует кристаллизацию, а повреждение канальцевых клеток способствует экспозиции участков богатых гиалуроном базальной мембраны к внутриканальцевой жидкости, из которой и могут осаждаться и формироваться кристаллы. Это было доказано на человеческом организме путем исследований процесса кристаллизации в корковом веществе трансплантированных почек [23], но, кроме одного исследования (пациенты с первичной гипероксалурией, 1-й тип, и пациенты с кальцийоксалатными камнями после шунтирующей операции по поводу ожирения), ни одного подобного процесса в сосочке описано не было.
Диапазон клинических фенотипов пациентов с конкрементами, возникшими на заглушках протоков Беллини, широкий. Они есть и у идиопатических кальцийоксалатных камнеобразователей, но состав их еще не определен. У пациентов с ГА- и БР-конкрементами почти всегда видны заглушки, так же как они могут быть и у пациентов с илеостомией или первичным гиперпаратиреозом. У пациентов с дистальным канальцевым почечным ацидозом после резекции тонкой кишки, с ожирением, шунтированием, цистинурией и первичной гипероксалурией 1-го типа [27, 10] также можно наблюдать заглушки, но реже.
Состояние насыщения мочи камнеобразующими веществами легко измерить, и есть некоторые данные, связывающие формирование заглушек протоков Беллини и кальцийфосфатных камней с высоким рН мочи, но сверхнасыщение недостаточное объяснение для такого различия кристаллов, найденных в заглушках и в разрастаниях. У пациентов с илеостомами заглушки вообще состоят из уратов и ГА, а рН мочи сохраняется около пяти, так что движущие силы одновременно для уратных солей и ГА отсутствуют. Резекция тонкой кишки приводит к образованию заглушек из ГА, несмотря на высокое насыщение СаОх и низкое CaP. Это правда, что значения сверхнасыщения связаны с возможным формированием соответствующих конкрементов, например насыщение СаР с ГА- или БР-конкрементами, но связь с образованием заглушек столь мала у пациентов с илеостомами или после резекции кишечника, что данный процесс должен контролироваться иными механизмами. При дистальном канальцевом ацидозе (ДКА) 1-го типа, отличающимся кальцийфосфатным камнеобразованием [9], может наблюдаться массивное формирование заглушек, состоящих преимущественно из ГА, тогда как насыщение CaP мочи не такое выокое, как у пациентов с БР-камнями, у которых количество заглушек Беллини значительно меньше.
Камни внутренних медуллярных собирательных канальцев
Неприкрепленные микролиты в дилатированных ВМСК можно было наблюдать вплоть до настоящего времени только при цистинурии (рис. 8). Микролиты цистина около 1–2 мм в диаметре могуть присутствовать в дистальных концах ВМСК и легко удаляются лазером (см. рис. 8, а, б).
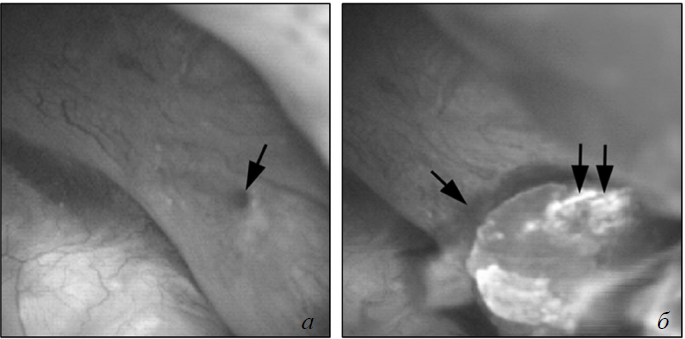
Рис. 8. Эндоскопическое вскрытие внутренних медуллярных собирательных канальцев с удалением протокового конкремента у пациента с цистинурией: а) в дистальных концах внутренних медуллярных собирательных канальцев находятся цистиновые микролиты, легко определяемые во время ретроградной нефролитотрипсии под уротелием, и выглядят как затемнение (стрелка) в области расширенного протока; б) лазерное рассечение выводного отверстия канальца приводит к легкому вымыванию микролитов из просвета внутренних медуллярных собирательных канальцев
Протоки Беллини могут быть закупорены цистиновыми кристаллами, но без крепления заглушек к канальцам, поэтому эти заглушки могут быть удалены без особых усилий, и при этом эпителий остается неизмененным [11]. Это отличает их от прочих заглушек протоков Беллини. Так как они круглые и не прикреплены к стенкам канальцев, то формирование в свободном растворе очевидное объяснение для камнеобразования при цистинурии.
Образование конкрементов в свободном растворе
В хирургической практике довольно часто обнаруживаются свободно лежащие в полостной системе почки камни, даже без намека на их открепление от сосочка. Имеются в виду камни CaOx при ПГ 1-го типа после шунтирующих операций по поводу ожирения, большинство БР- и ГА-камней и все цистиновые камни (рис. 9). В случае с микролитами в ВМСК при цистинурии застой мочи действует как питательная среда для камнеобразования. Также возможен рост камня после нуклеации при условии нарушения оттока мочи. Эти мысли если не полностью, то частично подтверждают гипотезу заглушек, согласно которой эти микрочастицы задерживаются в дистальных отделах канальцев и увеличиваются в размерах. Несомненно, множество различных кристаллов образуются в моче, подтверждение чему мы находим в многочисленных анализах мочи. Но проблема в том, что никто из нас никогда не наблюдал превращения этих кристаллов в конкременты, хотя эта идея давно уже витает в воздухе. У нас попросту не хватает весомых экспериментальных подтверждений либо опровержений этой гипотезы, без чего она остается всего лишь теорией.

Рис. 9. Цистиновые конкременты: а) свободно лежащие конкременты — эндоскопический вид; б) цистиновые камни, абсолютно гладкие, овальной формы, имеют гомогенную желтую окраску
Заключение
На сегодняшний день, немотря на то что патогенез мочекаменной болезни все еще остается малоизученным, распределение механизмов в группы на основании имеющихся данных позволяет обобщать различные фенотипы камнеобразователей, таким образом создавая благоприятные предпосылки и условия для дальнейшего поиска механизмов и разработки адекватных противорецидивных мер метафилактики.
About the authors
Petr S Baketin
A.M. Nikiforov Russian Center of Emergency and Radiation Medicine
Author for correspondence.
Email: pyotr-baketin@yandex.ru
urologist, Department of Urology Russian Federation
Rashid A Mollaev
Askerkhanov Central municipal hospital
Email: r_mollaev@mail.ru
urologist Russian Federation
Denis A Mazurenko
Urologic Clinic. EMC
Email: d.a.mazurenko@gmail.com
urologist, MD, PhD. Vice Director Russian Federation
Vladislav E Grigoryev
A.M. Nikiforov Russian Center of Emergency and Radiation Medicine
Email: vladislav.grigorev@outlook.com
urologist, Department of Urology Russian Federation
Nariman K Gadzhiev
A.M. Nikiforov Russian Center of Emergency and Radiation Medicine
Email: nariman.gadjiev@gmail.com
urologist, Department of Urology Russian Federation
Vladimir M Obidnyak
St Petersburg St Luka Clinical Hospital
Email: v.obidniak@gmail.com
MD, urologist. Department of Urology Russian Federation
Alexey V Pisarev
St Petersburg Multiprofile Center
Email: alexey.v.pisarev@gmail.com
MD, urologist. Department of Urology Russian Federation
Nair S Tagirov
St Petersburg St Elisabeth City Hospital
Email: ruslana73nair@mail.ru
MD, PhD, urologist Russian Federation
Vigen A Malkhasyan
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
Email: vigenmalkhasyan@gmail.com
Assistant, Department of Urology Russian Federation
Sergey B Petrov
A.M. Nikiforov Russian Center of Emergency and Radiation Medicine
Email: petrov-uro@yandex.ru
urologist, MD, Professor. Head of department of Urology Russian Federation
Sergei V Popov
A.M. Nikiforov Russian Center of Emergency and Radiation Medicine
Email: doc.popov@gmail.com
MD, PhD, Dr Med Sci, Head Doctor Russian Federation
References
- Васильев А.Г., Комяков Б.К., Тагиров Н.С., Мусаев С.А. Чрескожная нефролитотрипсия в лечении коралловидного нефролитиаза // Профилактическая и клиническая медицина. – 2009. – № 4. – С. 183–186. [Vasil’ev AG, Komjakov BK, Tagirov NS, Musaev SA. Percutaneous nephrolithotripsy in treatment of staghorn urolithiasis. Profilakticheskaja i klinicheskaja medicina. 2009;(4):183-186. (In Russ.)]
- Тагиров Н.С., Назаров Т.Х., Васильев А.Г., и др. Опыт применения чрескожной нефролитотрипсии и контактной уретеролитотрипсии в комплексном лечении мочекаменной болезни // Профилактическая и клиническая медицина. – 2012. – № 4. – С. 30–33. [Tagirov NS, Nazarov TH, Vasil’ev AG, et al. Combined PCNL and URS in urinary stone disease treatment. Profilakticheskaja i klinicheskaja medicina. 2012;(4):30-33. (In Russ.)]
- Трашков А.П., Васильев А.Г., Коваленко А.Л., Тагиров Н.С. Метаболическая терапия мочекаменной болезни на различных моделях поражения почек у крыс // Экспериментальная и клиническая фармакология. – 2015. – Т. 78. – № 3. – С. 17–21. [Trashkov AP, Vasil’ev AG, Kovalenko AL, Tagirov NS. Metabolic treatment of urolithiasis in different rat models. Eksperimental’naja i klinicheskaja farmakologija. 2015;78(3):17-21. (In Russ.)]
- Asplin JR, Parks JH, Coe FL. Dependence of upper limit of metastability on supersaturation in nephrolithiasis. Kidney Int. 1997;52:1602-8. doi: 10.1038/ki. 1997.491.
- Bergsland KJ, Worcester EM, Coe FL. Role of proximal tubule in the hypocalciuric response to thiazide of patients with idiopathic hypercalciuria. Am J Physiol Renal Physiol. 2013;305:F592-9. doi: 10.1152/ajprenal.00116.2013.
- Evan AP, Lingeman J, Coe F, et al. Renal histopathology of stone-forming patients with distal renal tubular acidosis. Kidney Int. 2007;71:795-801. doi: 10.1038/sj.ki.5002113.
- Evan AP, Lingeman JE, Coe FL, et al. Randall’s plaque of patients with nephrolithiasis begins in basement membranes of thin loops of Henle. J Clin Invest. 2003;111:607-16. doi: 10.1172/JCI17038.
- Evan AP, Lingeman JE, Coe FL, et al. Crystal-associated nephropathy in patients with brushite nephrolithiasis. Kidney Int. 2005;67:576-91. doi: 10.1111/j.1523-1755.2005.67114.x.
- Evan A, Lingeman J, Coe FL, Worcester E. Randall’s plaque: pathogenesis and role in calcium oxalate nephrolithiasis. Kidney Int. 2006;69:1313-8. doi: 10.1038/sj.ki.5000238.
- Evan AP, Coe FL, Gillen D, et al. Renal intratubular crystals and hyaluronan staining occur in stone formers with bypass surgery but not with idiopathic calcium oxalate stones. Anat Rec (Hoboken). 2008;291:325-34. doi: 10.1002/ar.20656.
- Evan AP, Coe FL, Lingeman JE, et al. Renal crystal deposits and histopathology in patients with cystine stones. Kidney Int. 2006;69:2227-35. doi: 10.1038/sj.ki.5000268.
- Evan AP, Coe FL, Lingeman JE, et al. Mechanism of formation of human calcium oxalate renal stones on Randall’s plaque. Anat Rec (Hoboken). 2007;290:1315-23. doi: 10.1002/ar.20580.
- Evan AP, Lingeman JE, Worcester EM, et al. Renal histopathology and cry*stal deposits in patients with small bowel resection and calcium oxalate stone disease. Kidney Int. 2010;78:310-7. doi: 10.1038/ki.2010.131.
- Evan AP. Histopathology predicts the mechanism of stone formation. AIP Conf Proc. 2007;900:15-25. doi: 10.1063/1.2723555.
- Evan AP, Lingeman JE, Coe FL, et al. Intra-tubular deposits, urine and stone composition are divergent in patients with ileostomy. Kidney Int. 2009;76:1081-8. doi: 10.1038/ki.2009.321.
- Evan AP, Lingeman JE, Worcester EM, et al. Contrasting histopathology and crystal deposits in kidneys of idiopathic stone formers who produce hydroxy apatite, brushite, or calcium oxalate stones. Anat Rec (Hoboken). 2014;297:731-48. doi: 10.1002/ar.22881.
- Gokhale JA, McKee MD, Khan SR. Immunocytochemical localization of Tamm-Horsfall protein in the kidneys of normal and nephrolithic rats. Urol Res. 1996;24:201-9. doi: 10.1007/BF00295893.
- Jamison R, Frey N, Lacy F. Calcium reabsorption in the thin loop of Henle. Am J Physiol (Leg Content). 1974;227.
- Kok DJ, Khan SR. Calcium oxalate nephrolithiasis, a free or fixed particle disease. Kidney Int. 1994;46:847-54. doi: 10.1038/ki.1994.341.
- Miller NL, Gillen DL, Williams JC, et al. A formal test of the hypothesis that idiopathic calcium oxalate stones grow on Randall’s plaque. BJU Int. 2009;103:966-71. doi: 10.1111/j.1464-410X.2008.08193.x.
- Miller NL, Williams JC, Evan AP, et al. In idiopathic calcium oxalate stone-formers, unattached stones show evidence of having originated as attached stones on Randall’s plaque. BJU Int. 2010;105:242-5. doi: 10.1111/j.1464-410X.2009.08637.x.
- Parks JH, Coward M, Coe FL. Correspondence between stone composition and urine supersaturation in nephrolithiasis. Kidney Int. 1997;51:894-900.
- Parks JH, Coe FL. Evidence for durable kidney stone prevention over several decades. BJU Int. 2009;103:1238-46. doi: 10.1111/j.1464-410X.2008.08170.x.
- Randall A. The origin and growth of renal calculi. Ann Surg. 1937;105:1009-27. doi: 10.1097/00000658-193706000-00014.
- Verkoelen C, Verhulst A. Proposed mechanisms in renal tubular crystal retention. Kidney Int. 2007;72:13-8. doi: 10.1038/sj.ki.5002272.
- Vermeulen CW, Lyon ES, Fried FA, et al. Mechanisms of genesis and growth of calculi. Am J Med. 1968;45:684-92. doi: 10.1016/0002-9343(68)90204-0.
- Worcester EM, Evan AP, Coe FL, et al. A test of the hypothesis that oxalate secretion produces proximal tubule crystallization in primary hyperoxaluria type I. Am J Physiol Renal Physiol. 2013;305:F1574-84. doi: 10.1152/ajprenal.00382.2013.
- Worcester EM, Coe FL, Evan AP, et al. Evidence for increased postprandial distal nephron calcium delivery in hypercalciuric stone-forming patients. Am J Physiol Renal Physiol. 2008;295: F1286-94. doi: 10.1152/ajprenal.90404.2008.
Supplementary files









