Клинико-неврологическая и нейрофизиологическая оценка эффективности двигательной реабилитации у детей с церебральным параличом при использовании роботизированной механотерапии и чреcкожной электрической стимуляции спинного мозга
- Авторы: Икоева Г.А.1,2, Никитюк И.Е.2, Кивоенко О.И.2, Мошонкина Т.Р.3, Солопова И.А.4, Сухотина И.А.3, Виссарионов С.В.2,5, Умнов В.В.2, Герасименко Ю.П.3
-
Учреждения:
- ГБОУ ВПО «СЗГМУ им. И.И. Мечникова» Минздрава России
- ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России
- ФГБУН «Институт физиологии им. И.П. Павлова» РАН
- ФГБУН «Институт проблем передачи информации им. А.А. Харкевича» РАН
- ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России
- Выпуск: Том 4, № 4 (2016)
- Страницы: 47-55
- Раздел: Статьи
- Статья получена: 09.01.2017
- Статья одобрена: 09.01.2017
- Статья опубликована: 14.12.2016
- URL: https://journals.eco-vector.com/turner/article/view/5895
- DOI: https://doi.org/10.17816/PTORS4447-55
- ID: 5895
Цитировать
Аннотация
Введение. Восстановительное лечение пациентов с детским церебральным параличом до сих пор является крайне сложной задачей. Устойчивые и нарастающие двигательные ограничения у таких больных обусловливают пожизненную необходимость в лечебных и реабилитационных мероприятиях. Нейрореабилитация детей с церебральным параличом на современном этапе не только включает в себя традиционные средства физической реабилитации, но и активно использует методики роботизированной механотерапии и новые технологии в области нейрофизиологии. Одной из таких технологий является неинвазивная чрескожная электростимуляция спинного мозга.
Цель исследования. Изучить влияние чрескожной электрической стимуляции спинного мозга на двигательные функции детей со спастической диплегией во время роботизированной механотерапии в системе «Локомат».
Материалы и методы. В статье представлено клиническое исследование 26 пациентов в возрасте от 6 до 12 лет с детским церебральным параличом. 11 пациентов (основная группа) получили курс роботизированной механотерапии на системе «Локомат» в сочетании с чрескожной электрической стимуляцией спинного мозга и 15 пациентов (контрольная группа) получили курс только роботизированной механотерапии.
Результаты. Сравнительный анализ в двух группах проводился на основании результатов клинического обследования с помощью специальных шкал (GMFCS, GMFM-88, Modified Ashworth Scale of Muscle Spasticity), локомоторных тестов (L-FORCE, L-ROM) и оценки активности мышц с помощью электромиографии. Было установлено, что в обеих группах после курса реабилитации отмечалось улучшение двигательных функций, но в основной группе, где использовалась чрескожная электростимуляция спинного мозга, положительная динамика была более значимой.
Заключение. На основании клинических данных, изменений показателей локомоторных тестов L-FORCE и L-ROM, а также по оценке изменений активности мышц можно заключить, что двигательная реабилитация детей со спастической диплегией с использованием роботизированной механотерапии в системе «Локомат» в сочетании с чрескожной электрической стимуляцией спинного мозга была более эффективной по сравнению с результатами изолированного применения роботизированной механотерапии.
Полный текст
Введение
Детский церебральный паралич (ДЦП) — это группа синдромов поражения центральной нервной системы, относящихся к непрогрессирующим патологическим состояниям, вызванным воздействием повреждающего агента на развивающийся мозг плода или ребенка во внутриутробном, интранатальном или раннем постнатальном периодах [1]. Повреждение мозга при этом проявляется расстройством мышечного тонуса, формированием парезов и параличей конечностей, нарушением позы тела и движения, приводящих к ограничению социальной активности больного [1]. Двигательные расстройства при ДЦП, как правило, сопровождаются нарушением познания и поведения, расстройствами речи, нарушением слуховых и зрительных функций, эпилептическими приступами [1]. Персистирующие двигательные нарушения приводят к формированию множественных контрактур и вторичных деформаций костных сегментов конечностей, которые формируются и прогрессируют в процессе роста и развития ребенка [2]. Несмотря на то, что ДЦП не является прогрессирующим заболеванием, его осложнения могут со временем усугублять инвалидизацию пациентов. Стойкие и нарастающие двигательные ограничения у больных церебральным параличом обусловливают пожизненную необходимость в лечебных и реабилитационных мероприятиях.
Восстановительное лечение пациентов с ДЦП до сих пор является крайне сложной задачей. Терапевтические методики у детей с церебральным параличом, как правило, направлены на борьбу со спастичностью, гиперкинезами и эпилептическими приступами, но они не приносят желаемого результата и успеха в борьбе с ортопедическими осложнениями, а вследствие этого физическая реабилитация таких пациентов крайне затруднена и не всегда приводит к улучшению двигательных функций [3–6]. Исследования последних лет в данной области показывают, что только использование современных высокотехнологичных и сочетанных видов помощи может принести ощутимые результаты в решении данной проблемы. Наиболее эффективным на сегодняшний день для таких пациентов признан комплекс мероприятий, включающих неврологическое, ортопедическое, нейрохирургическое лечение с последующей нейрореабилитацией [6–8].
Нейрореабилитация детей с церебральным параличом на современном этапе не только включает в себя традиционные средства физической реабилитации, но и активно использует роботизированные технологии [9–12] и новые достижения в области нейрофизиологии. Одной из таких технологий является неинвазивная электростимуляция спинного мозга [13]. В настоящее время в литературе стали появляться исследования, посвященные вопросам чрескожной спинальной электростимуляции у пациентов с ДЦП, которые указывают на эффективность и перспективность этой методики в двигательной реабилитации детей со спастическими параличами [14].
Цель исследования — изучить влияние чрескожной электрической стимуляции спинного мозга (ЧЭССМ) на двигательные функции детей со спастической диплегией во время роботизированной механотерапии в системе «Локомат».
Материал и методы
Объектом исследования явились 26 пациентов в возрасте от 6 до 12 лет (средний возраст 8,6 ± 3,4 года) с ДЦП, спастической диплегией. Степень нарушения интеллектуального развития оценивалась как легкая или средняя, все дети были доступны контакту и могли четко выполнять задания инструктора. Всем пациентам ранее проводилось поэтапное хирургическое или консервативное ортопедическое лечение, направленное на устранение спастичности мышц и контрактур нижних конечностей. После каждого этапа пациенты получали курсы реабилитации с целью улучшения двигательной активности. В зависимости от вариантов восстановительной терапии пациенты были разделены на две группы: основную и контрольную. В основную группу входили 11 детей, которые получили 15 процедур роботизированной механотерапии на системе «Локомат» длительностью 45 мин в сочетании с ЧЭССМ. В контрольной группе было 15 детей, которые получили 15 процедур роботизированной ходьбы длительностью 45 мин без применения ЧЭССМ [15].
Для оценки результатов лечения использовали следующие методы.
- Модифицированная шкала спастичности Эшворта (Modified Ashworth Scale of Muscle Spasticity). Оценивали степень спастичности мышц нижних конечностей до начала роботизированной механотерапии и после ее окончания [16].
- Шкала больших моторных функций GMFCS (уровень развития двигательных навыков) и GMFM-88 (глобальная оценка моторных функций). Оценка уровня моторных функций и изменения больших моторных функций у детей с церебральным параличом проводилась в динамике в начале и в конце курса механотерапии [17].
- Тест L-FORCE — стандартный тест, входящий в программное обеспечение тренажера «Локомат». Он производит изометрическую оценку мышечной силы в ньютонометрах (Nm) в четырех мышечных группах: сгибателях/разгибателях бедра, сгибателях/разгибателях голени на правой и левой нижней конечностях соответственно.
- Тест L-ROM — стандартный тест, включенный в программное обеспечение системы «Локомат». Он оценивает объем пассивного движения при сгибании и разгибании коленного и тазобедренного суставов (в градусах).
- Оценка активности мышц нижних конечностей. Оценку мышечной активности осуществляли путем телеметрической регистрации электрогенеза мышц нижних конечностей во время совершения пациентом самостоятельных шаговых движений по ленте тредбана системы «Локомат». С этой целью ребенка закрепляли в тренажере «Локомат» и приподнимали над тредбаном таким образом, чтобы он мог совершать шаговые движения по движущейся ленте. Скорость ленты тредбана была подобрана таким образом, чтобы пациент во время ходьбы не терял с ней контакта, и составляла от 0,3 до 1,5 км/ч [18].
Оценку активности мышц проводили следующим образом: фильтрацию сигнала от сетевых наводок 50 Гц осуществляли согласно выражению
Af(t) = A(t) – A(t – 0,02),
где A(t) — исходный сигнал ЭМГ.
Таким образом, из текущего сигнала вычитался такой же сигнал, сдвинутый на 0,02 с вперед. Также сигнал фильтровался от низкочастотных артефактов до 20 Гц. Временной интервал, в котором изучался сигнал, составлял около 20 с и выбирался вручную так, чтобы в течение этого интервала имело место устоявшееся периодическое движение. Спектр сигнала ЭМГ предполагалось ограничить диапазоном 20–500 Гц, поэтому в соответствии с теоремой Котельникова (Найквиста – Шеннона) была выбрана частота оцифровки сигнала 1 кГц. Спектр Фурье строился в области 20–500 Гц.
Преобразование Фурье сигнала ЭМГ A(t) (см. PDF).
Хорошие результаты при построении картины вейвлет-преобразования дают следующие значения параметров: t1 = 0,225 c (225-я точка окна, за нулевое время каждый раз берется начало окна), t2 = 0,275 c (275-я точка окна), n = 7. При таких параметрах достигается качественное соответствие оконного преобразования Фурье вейвлет-преобразованию, выполненному стандартными методами, например вейвлету Морле. Таким образом, окном выделяется 500 точек, из которых активных — лишь 50, а за пределами активного участка идет резкое уменьшение сигнала во избежание колебательных артефактов в области низких частот спектра Фурье. В описанном выше окне строится Фурье-преобразование, вычисляется зависимость коэффициентов спектра Фурье от времени и от частоты. На частотно-временную плоскость отображаются спектральные коэффициенты, цвет точки соответствует величине коэффициента, и таким образом получается характерная картина вейвлет-преобразования [19] (рис. 1).
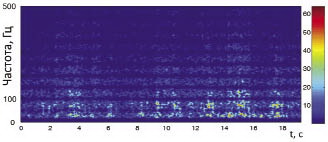
Уровень сигнала ЭМГ нормировался так, чтобы максимальный коэффициент спектра Фурье во всей записи равнялся 64, что соответствует белому цвету шкалы оттенков серого.
Относительное время активного состояния
По вейвлет-преобразованию определялось активное состояние мышцы и относительное время активного состояния. Для этого вычислялся порог, различающий покой и активное состояние. Средняя мощность спектра определялась как (см. PDF)
Также рассчитывалась средняя мощность спектра Icp(200÷400) в диапазоне 200–400 Гц на выбранном временном интервале. Такой выбор высоких частот обусловлен тем, что при активном усилии ЭМГ обладает и высокочастотными составляющими сигнала. К тому же спектр ЭМГ в области высоких частот хорошо коррелирует с развиваемой мышцей силой.
Порог определения активного состояния мышцы задавался соотношением
L = (1 + 0,2 (5,5 – Icp)/4,5) Icp(200÷400).
Коэффициенты в нем подобраны таким образом, что при большом Icp порог снижается до 0,8Icp(200÷400), при малом — увеличивается до 1,2Icp(200÷400).
В каждый момент исследуемого участка вейвлет-преобразования сравниваются порог L и спектральная мощность в данный момент времени в диапазоне 200–400 Гц. Когда значение этой мощности выше порога, момент времени считается «активным», когда значение этой мощности ниже — момент времени считается «пассивным» (рис. 2).
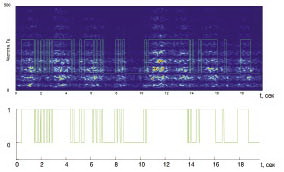
Относительная длительность активности определялась как отношение активного времени к продолжительности всего исследуемого участка электромиограммы: τ = ta/t.
Все исследования у пациентов проводили дважды — в начале и в конце курса роботизированной механотерапии. Для сравнения были определены нормативные значения исследуемых показателей у 10 здоровых детей той же возрастной группы.
Результаты и обсуждение
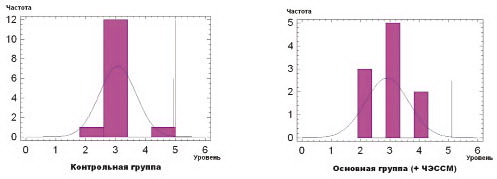
В исследовании участвовали дети с уровнем развития моторных навыков 2–4 по шкале GMFCS. Эти показатели оставались стабильными на протяжении всего исследования, так как уровень моторных навыков не может измениться за короткий период времени даже при очень интенсивной реабилитации. Результаты оценки моторных функций по шкале GMFCS у детей с ДЦП представлены на рис. 3.
Степень спастичности мышц нижних конечностей по шкале Эшворта в преобладающем большинстве составляла 1–2 балла, эта величина также оставалась постоянной в процессе исследования вследствие низкой чувствительности к коротким курсам реабилитационных мероприятий. Результаты оценки по шкале Эшворта представлены на рис. 4.
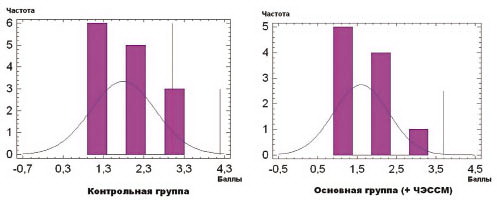
Из представленных диаграмм на рис. 3 и 4 видно, что контрольная и основная группы пациентов являлись клинически однородными: различия по уровню GMFCS (соответственно 3,2 ± 0,17 и 2,9 ± 0,23) и степени спастичности (соответственно 1,8 ± 0,21 и 1,6 ± 0,22 балла) были статистически незначимыми (p > 0,05).
Оценка больших моторных функций по шкале GMFM-88 у большинства пациентов показала изменение результатов на протяжении исследования, результаты представлены на рис. 5.
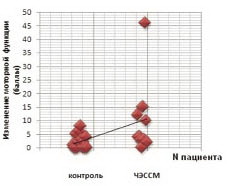
Данные рис. 5 показывают, что 90 % пациентов основной группы после окончания курса роботизированной механотерапии в сочетании с ЧЭССМ достигли положительных результатов при оценке двигательных функций по шкале GMFM-88. Средний балл по шкале GMFM-88 к моменту окончания курса реабилитации увеличился на 9,9 ± 4,3 %. Таким образом, у пациентов этой группы прослеживается достаточно выраженная положительная динамика, заключающаяся в увеличении среднего показателя двигательных функций по шкале GMFM-88. В контрольной группе пациентов после окончания курса роботизированной механотерапии без сочетания с ЧЭССМ положительные результаты при оценке двигательных функций по шкале GMFМ-88 достигли только 50 % больных. Увеличение среднего показателя двигательных функций нижних конечностей у этой группы больных было незначительным и составило только 2,5 ± 0,78 %, что достоверно ниже, чем в основной группе (p < 0,05).
Результаты оценки мышечной силы и объема движений в нижних конечностях при помощи локомоторных тестов системы «Локомат» L-FORCE и L-ROM представлены в табл. 1 и 2.
Таким образом, согласно результатам исследования как в основной, так и в контрольной группе пациентов после курса реабилитационных мероприятий наблюдалось существенное (p < 0,05, тест Манна – Уитни) увеличение объемов движений в правом и левом тазобедренных суставах, причем в правом тазобедренном суставе это увеличение было больше в основной группе больных. Значимое (p < 0,05) увеличение объема движений в левом и правом коленных суставах наблюдалось только в основной группе.
Таблица 1. Изменение показателей по тесту L-FORCE в основной и контрольной группах после курса роботизированной механотерапии
Группа | Увеличение силы мышц нижних конечностей (% пациентов) | |||
сгибание в тазобедренном суставе | разгибание в тазобедренном суставе | сгибание в коленном суставе | разгибание в коленном суставе | |
Основная | 60 | 45 | 70 | 55 |
Контрольная | 36 | 36 | 33 | 36 |
Таблица 2. Объем движений в тазобедренных и коленных суставах по тесту L-ROM в основной и контрольной группах до и после курса роботизированной механотерапии
Группа | Объем движений в суставах нижних конечностей (в градусах) | |||||||
левый тазобедренный сустав | правый тазобедренный сустав | левый коленный сустав | правый коленный сустав | |||||
Норма | 51 ± 6 | 50 ± 20 | ||||||
до | после | до | после | до | после | до | после | |
Основная | 25 ± 12 | 34 ± 13* | 24 ± 10 | 35 ± 15* | 15 ± 9 | 22 ± 16* | 13 ± 8 | 18 ± 15* |
Контрольная | 25 ± 10 | 33 ± 11* | 25 ± 13 | 34 ± 12* | 22 ± 14 | 25 ± 15 | 21 ± 15 | 21 ± 14 |
Примечание: * p < 0,05 значимая разница в условиях до/после.
Оценка активности мышц
На графиках приведены усредненные значения относительной длительности активного состояния мышц для каждой исследуемой мышцы в основной и контрольной группах детей. На каждом графике (рис. 6) представлены результаты до и после реабилитационных процедур.
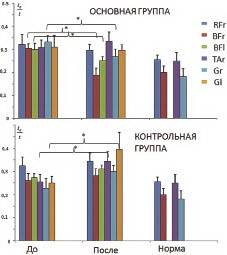
Из графика видно, что практически во всех исследуемых мышцах до начала реабилитации как в основной, так и в контрольной группе относительная длительность активного состояния мышц была существенно повышена по сравнению со значениями этого параметра у здоровых детей. После реабилитации в основной группе (с ЧЭССМ) в двуглавых мышцах бедер и передних большеберцовых мышцах наблюдалось достоверное снижение длительности активного состояния в сторону нормализации, в то время как у пациентов контрольной группы, наоборот, во всех мышцах наблюдалось увеличение этого параметра. Более информативную картину динамики относительной длительности активного состояния мышц дает сравнительная оценка изменения усредненного значения этого параметра до и после лечебных процедур, представленная графически (рис. 7). Положительные изменения значений этого параметра в основной группе пациентов говорят об уменьшении относительной длительности активного состояния мышц, что свидетельствует о положительной динамике, поскольку изначально у детей с ДЦП активность мышц повышена вследствие спастичности. В контрольной группе отрицательные изменения значений этого параметра при «воздушной» ходьбе (либо слабоположительные на тредбане) в целом указывают на увеличение длительности активного состояния мышц после процедур, то есть на стойкое сохранение патологических механизмов вовлечения мышц в двигательный акт.
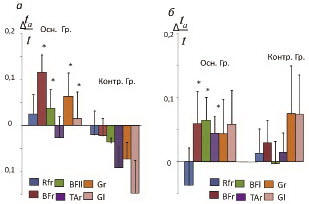
Таким образом, из результатов обследования электромиографической активности мышц в цикле шага следует отметить, что роботизированная механотерапия с использованием ЧЭССМ способствует изменению паттернов активности мышц в сторону нормализации, в то время как при реабилитации без ЧЭССМ динамика отсутствует или даже наблюдаются изменения в противоположную сторону.
Заключение
На основании представленных данных, как по результатам клинических показателей, так и по результатам изменений локомоторных тестов L-FORCE и L-ROM, а также по оценке изменений активности мышц можно заключить, что двигательная реабилитация детей с ДЦП с использованием роботизированного комплекса «Локомат» в сочетании с ЧЭССМ была более эффективной по сравнению с результатами изолированного применения этой системы.
Информация о финансировании и конфликте интересов
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации, грант № 14.576.21.0020 (уникальный идентификатор соглашения RFMEFI57614X0020).
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Об авторах
Галина Александровна Икоева
ГБОУ ВПО «СЗГМУ им. И.И. Мечникова» Минздрава России; ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России
Автор, ответственный за переписку.
Email: ikoeva@inbox.ru
канд. мед. наук, доцент кафедры детской неврологии и нейрохирургии ГБОУ ВПО «СЗГМУ им. И.И. Мечникова» Минздрава России. Заведующая отделением двигательной реабилитации ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России Россия
Игорь Евгеньевич Никитюк
ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России
Email: femtotech@mail.ru
канд. мед. наук, ведущий научный сотрудник лаборатории физиологических и биомеханических исследований Россия
Ольга Ивановна Кивоенко
ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России
Email: rt-k@yandex.ru
врач-невролог, заведующая реабилитационным отделением Россия
Татьяна Рамульевна Мошонкина
ФГБУН «Институт физиологии им. И.П. Павлова» РАН
Email: fake@eco-vector.ru
канд. биол. наук, старший научный сотрудник Россия
Ирина Александровна Солопова
ФГБУН «Институт проблем передачи информации им. А.А. Харкевича» РАН
Email: fake@eco-vector.ru
канд. биол. наук, ведущий научный сотрудник Россия
Ирина Александровна Сухотина
ФГБУН «Институт физиологии им. И.П. Павлова» РАН
Email: fake@eco-vector.com
канд. биол. наук, старший научный сотрудник Россия
Сергей Валентинович Виссарионов
ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России; ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России
Email: turner01@mail.ru
д-р мед. наук, проф., заместитель директора по научной и учебной работе, руководитель отделения патологии позвоночника и нейрохирургии, профессор кафедры детской травматологии и ортопедии Россия
Валерий Владимирович Умнов
ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России
Email: umnovvv@gmail.com
д-р мед. наук, руководитель отделения детского церебрального паралича Россия
Юрий Петрович Герасименко
ФГБУН «Институт физиологии им. И.П. Павлова» РАН
Email: fake@eco-vector.com
д-р биол. наук, проф., чл.-корр. РАН, заведующий лабораторией Россия
Список литературы
- Бадалян Л.О., Журба Л.Т., Тимонина О.В. Детские церебральные параличи: ДЦП, ЛФK, неврология. — М.: Книга по Требованию, 2013. — 325 с. [Badalyan LO, Zhurba LT, Timonina OV. Detskie tserebral’nye paralichi: DTsP, LFK, nevrologiya. Moscow: Kniga po Trebovaniyu; 2013. 325 p. (In Russ.)]
- Умнов В.В. Нейрохирургические аспекты комплексного ортопедо-нейрохирургического лечения спастических параличей у детей // Вестник Российской военно-медицинской академии. — 2008. — № 1. — С. 87–91. [Umnov VV. Neurosurgical aspects of complex orthopedic and neurosurgical treatment of children with spastic paralysis. Vestnik Rossiyskoy voenno-meditsinskoy akademii. 2008;(1):87-91. (In Russ.)]
- Белова А.Н. Нейрореабилитация: руководство для врачей. — М.: Антидор, 2000. — 566 с. [Belova AN. Neyroreabilitatsiya: rukovodstvo dlya vrachey. Moscow: Antidor; 2000. 566 p. (In Russ.)]
- Вернер Д. Реабилитация детей-инвалидов. — М.: Филантроп, 1995. — 676 с. [Verner D. Reabilitatsiya detey-invalidov. Moscow: Filantrop; 1995. 676 p. (In Russ.)]
- Chung CY, Chen CL, Wong AM. Pharmacotherapy of spasticity in children with cerebral palsy. J Formos Med Assoc. 2011;110:215-222.
- Кожевникова В.Т. Современные технологии в комплексной физической реабилитации больных детским церебральным параличом. — М.: ПБОЮЛ «Т.М. Андреева», 2005. — 238 с. [Kozhevnikova VT. Sovremennye tekhnologii v kompleksnoy fizicheskoy reabilitatsii bol’nykh detskim tserebral’nym paralichom. Moscow: PBOYuL “T.M. Andreeva”; 2005. 238 p. (In Russ.)]
- Боголюбов В.М., Пономаренко Г.Н. Общая физиотерапия. — М.: Медицина, 2003. — 430 с. [Bogolyubov VM, Ponomarenko GN. Obshchaya fizioterapiya. Moscow: Meditsina; 2003. 430 p. (In Russ.)]
- Лильин Е.Т., Доскин В.А. Детская реабилитология. — М.: Литтера, 2011. — 380 с. [Lil’in ET, Doskin VA. Detskaya reabilitologiya. Moscow: Littera; 2011. 380 p. (In Russ.)]
- Черникова Л.А., Клочков А.С. Влияние тренировок на роботизированной системе Lokomat на мобильность при ходьбе у больных с постинсультными гемипарезами // Вопросы курортологии, физиотерапии и лечебной физической культуры. — 2014. — Т. 91. — Вып. 3. — С. 13–17. [Chernikova LA, Klochkov AS. The influence of physical training with the use of a Lokomat robotic system on the walking ability of the patients presenting with post-stroke hemiparesis. Voprosy kurortologii, fizioterapii i lechebnoy fizicheskoy kul’tury. 2014;91(3):13-17. (In Russ.)]
- Johnston TE, Watson KE, et al. Effects of a supported speed treadmill training exercise program on impairment and function for children with cerebral palsy. Dev Med Child Neurol. 2011;53(8):742-750.
- Smania N, Bonetti P, Gandolfi M, et al. Improved gait after repetitive locomotor training in children with cerebral palsy. Am J Phys Med Rehabil. 2011;90(2):137-149. doi: 10.1097/phm.0b013e318201741e.
- Икоева Г.А., Кивоенко О.И., Полозенко О.Д. Роботизированная механотерапия в реабилитации детей с церебральным параличом после комплексного ортопедо-хирургического лечения // Нейрохирургия и неврология детского возраста. — 2012. — №. 4. — С. 32–36. [Ikoeva GA, Kivoenko OI, Polozenko OD. Use of robot-drive mechanotherapy in children with the cerebral palsy after complex ortopedical and surgical treatment. Pediatric Neurosurgery and Neurology. 2012;(4):32-36. (In Russ.)]
- Gorodnichev RM, Pivovarova EA, Puhov A, et al. Transcutaneous electrical stimulation of the spinal cord: a noninvasive tool for the activation of stepping pattern generators in humans. Human Physiology. 2012;38(2):158-167. doi: 10.1134/S0362119712020065.
- Xu KS, He L, Li JL, Mai JN. Effects of transcutaneous electrical nerve stimulation on motor function in ambulant children with spastic cerebral palsy: a randomized trial. Zhonghua Er Ke Za Zhi. 2007;45(8):564.
- Икоева Г.А., Кивоенко О.И., Мошонкина Т.Р., и др. Сравнительный анализ эффективности двигательной реабилитации детей с церебральным параличом с использованием роботизированной механотерапии и чрескожной электрической стимуляции спинного мозга // Международный журнал прикладных и фундаментальных исследований. — 2016. — № 2 (часть 2). — С. 200–203. [Ikoeva GA, Kivoenko OI, Moshonkina TR. Comparative analysis of the efficiency of the motor rehabilitation in children with cerebral palsy using robotic mechanotherapy and transcutaneos electrical stimulation of the spinal cord. Mezhdunarodnyj zhurnal prikladnyh i fundamental’nyh issledovanij. 2016;2(2):200-203. (In Russ.)]
- Bohannon RW, Smith MB. Interrater reliability of a modified Ashworth scale of muscle spasticity. Phys Ther. 1987;67(2):206-207.
- Russell DJ, Rosenbaum PL, Cadman DT, et al. The gross motor function measure: a means to evaluate the effects of physical therapy. Dev Med Child Neurol. 1989;31(3):341-352. doi: 10.1111/j.1469-8749.1989.tb04003.x.
- Богачева И.Н., Мошонкина Т.Р., Боброва Е.В., и др. Эффект чрескожной электрической стимуляции спинного мозга и механотерапии в регуляции активности мышц ног // Вестник Тверского государственного университета. Сер. «Биология и экология». — 2015. — № 2. — С. 7–17. [Bogacheva IN, Moshonkina TR, Bobrova EV, et al. Effect of transcutaneous electrical spinal cord stimulation and mechanotherapy in the muscle activity regulation. Vestnik Tverskogo gosudarstvennogo universiteta. Ser. Biologiya i ekologiya. 2015;(2):7-17. (In Russ.)]
- Stackhouse SK, Binder-Macleod SA, Lee SCK. Voluntary muscle activation, contractile properties, and fatigability in children with and without cerebral palsy. Muscle and Nerve. 2005;31(5):594-601. doi: 10.1002/mus.20302.
Дополнительные файлы









