Чувствительность к антибиотикам эшерихий, выделенных в многопрофильном стационаре
- Авторы: Козлова Н.С.1, Баранцевич Н.Е.2, Баранцевич Е.П.2
-
Учреждения:
- ГБОУВО «Северо-западного государственного медицинского университета им. И.И. Мечникова»
- ФГБУ «Северо-Западного федерального медицинского исследовательского центра им. В. А. Алмазова»
- Выпуск: Том 65, № 4 (2016)
- Страницы: 83-89
- Раздел: Статьи
- Статья получена: 15.09.2016
- Статья опубликована: 15.09.2016
- URL: https://journals.eco-vector.com/jowd/article/view/5826
- DOI: https://doi.org/10.17816/JOWD65483-89
- ID: 5826
Цитировать
Полный текст
Аннотация
Актуальность. В настоящее время крайне актуальной остается проблема антибиотикорезистентности микроорганизмов, циркулирующих в стационарах. Цель исследования. Изучениеантибиотикорезистентности эшерихий, выделенных от пациентов многопрофильного стационара, включающего перинатальный центр.
Материалы и методы. Методом серийных разведений определена чувствительность к 15 антибактериальным препаратам 1٥1 штамма эшерихий, выделенных из различного материала пациентов многопрофильного стационара.
Результаты. Показано, что большая часть изученных культур (67,5 %) оказалась устойчива к антибиотикам, в том числе к ампициллину (57,0 %), ципрофлоксацину и моксифлоксацину (по 42,4 %), цефалоспоринам III (по 37,1 %) и IV (34,4 %) поколения и гентамицину (29,1 %). Выявлен высокий уровень ассоциированной резистентности к антибиотикам разных групп, чаще всего к цефалоспоринам и фторхинолонам (29,1 %). Наибольшую активность в отношении эшерихий проявляли карбапенемы (устойчивость к эртапенему 2,6 %, меропенему — 0,7 %), особенно имипинем, к которому не было выявлено устойчивых культур. Сохраняли активность также фосфомицин (резистентность 1,3 %) и амикацин (3,3 %). Выявлено большое разнообразие спектров антибиотикорезистентности эшерихий с высоким удельным весом полирезистентных культур (48,0 %).
Заключение. Проведенный анализ чувствительности эшерихий, выделенных в стационаре, к антимикробным препаратам, показал превалирование среди них антибиотикорезистентных культур с высоким удельным весом полирезистентных штаммов. Опасным прогностическим признаком является появление в стационаре эшерихий, устойчивых к карбапенемам.
Полный текст
ВВЕДЕНИЕ
Распространение антибиотикорезистентных штаммов микроорганизмов приняло в настоящее время характер эпидемии. В большинстве стран устойчивость возбудителей инфекционных заболеваний к антимикробным препаратам (АМП) неизменно растет. Предотвращение формирования и распространения антимикробной резистентности признано ВОЗ в качестве глобальной проблемы и национального приоритета [1]. Выраженное разнообразие генов и механизмов резистентности особенно характерно для энтеробактерий, которые являются важными возбудителями как внебольничных, так и госпитальных инфекций разной локализации, в том числе инфекций мочевыводящих путей и респираторного тракта [2, 3]. При госпитальных инфекциях энтеробактерии по актуальности делят 1–2-е места со стафилококками как во взрослых, так и в детских стационарах [1, 4–6]. Из них превалируют Escherichia coli, достигая ٧٠–95 % при неосложненных инфекциях мочевыводящих путей, при этом для эшерихий характерна устойчивость к антибиотикам разных групп [6, 7]. Ведущим механизмом резистентности к бета-лактамным антибиотикам у энтеробактерий является выработка бета-лактамаз расширенного спектра (БЛРС), гены которых локализуются на плазмидах и способны передаваться при внутривидовой, межвидовой и даже межродовой передаче, при этом микроорганизмы отличаются ассоциированной резистентностью к другим антибиотикам: гентамицину — до 80 %, ципрофлоксацину — 40–60 % [2]. Так, при исследовании 573 штаммов энтеробактерий из 25 стационаров 18 городов России в 2011–2012 гг. продукция БЛРС была обнаружена у 82,1 % E. coli [8].
Учитывая высокий уровень резистентности эшерихий к антимикробным препаратам разного механизма действия и его выраженную вариабельность в зависимости от региона и даже стационара, очень важным представляется изучение антибиотикорезистентности этих микроорганизмов, особенно выделенных в многопрофильных стационарах [2, 9], что и явилось целью нашего исследования.
МАТЕРИАЛЫ И МЕТОДЫ
В сентябре 2015 — феврале 2016 г. в многопрофильном стационаре г. Санкт-Петербурга, включающем перинатальный центр, из различного материала пациентов (мочи, мокроты, бронхоальвеолярного лаважа (БАЛ), крови, отделяемого ран, носа, зева и др.) был выделен 151 штамм Escherichia coli. Более половины культур (64,2 %) были выделены из мочи. Удельный вес изолятов E. coli из различного клинического материала представлен на рис. 1.

Идентификация этиологически значимых микроорганизмов осуществлялась фенотипически и по последовательности первых 500 пар нуклеотидов гена 16S РНК [10]. Определение чувствительности выделенных чистых культур энтеробактерий к антибактериальным препаратам проводилось методом серийных разведений в агаре Мюллер — Хинтон с диапазоном концентраций от 0,06 до 128 мкг/мл [11].
Была определена чувствительность всех штаммов к 15 антибактериальным препаратам: ампициллину (Ap), цефотаксиму (Ctx), цефепиму (Cpm), цефтазидиму (Czd), цефтриаксону (Cta), комбинациям амоксициллин / клавуланат (Am/cl), цефоперазон / сульбактам (Cfp/sb), ципрофлоксацину (Cip), моксифлоксацину (Mox), имипенему (Im), меропенему (Mer), эртапенему (Ert), гентамицину (Gm), амикацину (Ak), фосфомицину (Fm). Были использованы референтные штаммы E. coli АТСС 25922, E. coli АТСС 35218. Определение категорий чувствительности на основании полученных МИК проводили в соответствии с рекомендациями European Committee on Antimicrobial Susceptibility Testing (2013) [11]. Статистическую обработку полученных данных проводили с помощью пакета прикладных программ SPSS Statistics 17.0 (США) [12]. Для анализа результатов исследования использованы методы описательной статистики: частоты, проценты, частотные распределения и т. п.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенный анализ чувствительности эшерихий, выделенных в стационаре, к антимикробным препаратам, показал высокий уровень их антибиотикорезистентности. Большая часть изученных культур (67,5 %) оказались устойчивы хотя бы к одному антибактериальному препарату, при этом не было выявлено чувствительных к антибиотикам штаммов среди изолятов, выделенных из ран. Высоким был удельный вес устойчивых штаммов среди изолятов, выделенных из крови (87,3 %), меньше всего таких культур было в моче (36,1 %) и респираторном тракте (42,9 %).
Среди эшерихий превалировали культуры, устойчивые к ампициллину (57,0 %), ципрофлоксацину и моксифлоксацину (по 42,4 %), что делает применение этих препаратов в виде монотерапии инфекций, вызванных эшерихиями, нецелесообразным. Более трети штаммов были устойчивы к цефалоспоринам III (по 37,1 %) и IV (34,4 %) поколения (рис. 2).
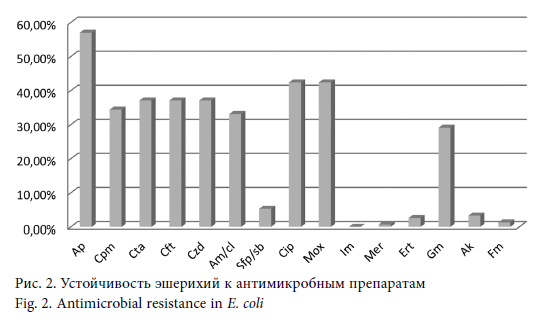
Полученные нами данные коррелируют с данными по устойчивости эшерихий к цефалоспоринам в других лечебных учреждениях Санкт-Петербурга. Так, среди E. coli, выделенных в семи стационарах Санкт-Петербурга в 2012 г., удельный вес штаммов, устойчивых к цефалоспоринам, колебался в различных стационарах от ٧,٨ до ٥٠ ٪ [14]. В исследовании МАРАФОН в стационарах России устойчивость к цефалоспоринам III–IV поколений выявлена более чем у 80 % культур E. coli [8]. Основным механизмом устойчивости к цефалоспоринам у энтеробактерий является продукция бета-лактамаз расширенного спектра действия (БЛРС), при этом гены, их кодирующие, часто локализуются на плазмидах и распространяются среди микроорганизмов. Среди нозокомиальных штаммов в отделениях реанимации и интенсивной терапии (ОРИТ) стационаров России доля продуцентов БЛРС достигала 55 % среди эшерихий, отличаясь даже между стационарами одного города [15]. Зарубежные исследования показывают меньшую распространенность продуцентов БЛРС среди эшерихий, однако количество таких культур и там постоянно увеличивается [16, 17]. В большом международном исследовании в 2011 г. было выявлено, что за период с 2008 по 2011 г.
в большинстве стран наблюдалось выраженное увеличение удельного веса устойчивых к цефалоспоринам III поколения культур, и ни в одной стране не было выявлено снижение количества таких штаммов среди эшерихий [16, 17]. Таким образом, частоту БЛРС у эшерихий — возбудителей нозокомиальных инфекций в ОРИТ России можно считать рекордно высокой [15], что делает цефалоспорины неэффективными в лечении вызываемых этими микроорганизмами инфекций. Более того, широкое использование цефалоспоринов, помимо роста резистентности к ним самим, сопровождается селекцией и распространением полирезистентных БЛРС-продуцирующих энтеробактерий (концепция «параллельного
ущерба») [3, 18].
Безусловный интерес представляет ассоциированная устойчивость эшерихий к разным антимикробным препаратам, которая приводит к формированию полирезистентных и панрезистентных штаммов. В нашем исследовании почти треть изученных культур обладали ассоциированной резистентностью к цефалоспоринам и фторхинолонам (29,1 %), реже наблюдалась ассоциированная устойчивость к фторхинолонам и аминогликозидам (22,5 %) и цефалоспоринам и аминогликозидам (14,6 %). Одновременная резистентность сразу к трем группам препаратов (цефалоспоринам, фторхинолонам и аминогликозидам) встречалась у 12,6 % изученных эшерихий. Все вышесказанное, безусловно, снижает эффективность использования данных комбинаций для терапии инфекций различной локализации, вызванных эшерихиями. В определенной части случаев в связи с гиперпродукцией БЛРС в отношении эшерихий неэффективны и ингибиторзащищенные бета-лактамы — до 40,5 % [1]. В нашем исследовании удельный вес эшерихий, устойчивых к комбинации амоксициллин клавуланат, составил треть изученных культур (33,1 %), значительно большую активность проявляла комбинация цефоперазон / сульбактам (5,3 % резистентных штаммов).
Почти треть выделенных культур оказалась устойчива к гентамицину (29,1 %), амикацин был гораздо активнее в отношении эшерихий (3,3 % резистентных штаммов). Для кишечной палочки характерной осталась чувствительность к фосфомицину, к которому были выявлены только две устойчивые культуры (1,3 %). Показано, что резистентность E. coli к этому препарату со временем меняется очень незначительно, и во всем мире обычно не превышает 5 %, что, возможно, связано с особенностями механизма его действия, препятствующими развитию к нему устойчивости [3]. К преимуществам препарата можно отнести отсутствие перекрестной устойчивости с другими антимикробными препаратами, редкую плазмидную передачу генов резистентности (менее 2 %), а также доказанное предупреждение адгезии возбудителя к эпителию мочевыводящих путей, что делает фосфомицин по-прежнему актуальным для терапии инфекций, особенно мочевыводящих путей [3].
Наиболее активными среди изученных препаратов в отношении эшерихий оказались карбапенемы. Вследствие высокого удельного веса энтеробактерий, продуцирующих БЛРС и устойчивых к цефалоспоринам, возросла роль и частота применения карбапенемов, которые в настоящее время широко используются в качестве препаратов стартовой эмпирической терапии, и это создает условия для селекции представителей этого семейства, продуцирующих карбапенемазы [19]. До последнего времени удельный вес устойчивых к карбапенемам энтеробактерий в мире оставался невысоким. Так, в 2011 г. из 73920 штаммов энтеробактерий, выделенных в 28 странах, устойчивыми к карбапенемам были только 1,8 %, причем большинство устойчивых культур было выявлено в Греции [16]. Ранее считалось, что в России резистентность энтеробактерий к карбапенемам практически отсутствует [9, 20], однако уже около десяти лет устойчивые к карбапенемам штаммы энтеробактерий регистрируются в разных регионах России [8, 13, 14]. Так, в исследовании МАРАФОН резистентность к меропенему, имипенему и эртапенему проявляли соответственно 2,8, 8,4 и 14,0 % всех изолятов энтеробактерий. В настоящее время удельный вес резистентных к карбапенемам культур достигает в отдельных стационарах 30 % [4]. Среди эшерихий в проведенном нами исследовании устойчивость к карбапенемам была невысока: так, только четыре штамма оказались устойчивыми к эртапенему (2,6 %), только один — к меропенему (0,7 %), не было выявлено культур, устойчивых к имипенему. Устойчивость к цефалоспоринам III поколения и карбапенемам является маркером полирезистентности энтеробактерий [17].
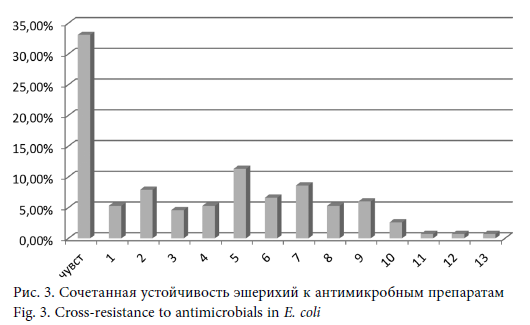
Среди эшерихий чаще выявлялись штаммы, устойчивые к пяти (11,3 %), двум (9,9 %) и семи (8,6) антимикробным препаратам (рис. 3). Несколько реже встречались культуры, одновременно устойчивые к двенадцати (7,9 %), шести (6,6 %), девяти (6,0 %), одному, четырем и восьми (по 5,3 %) и трем (4,6 %) антибиотикам (рис. 4). В целом полирезистентные штаммы (устойчивые к 3 и более препаратам разного механизма действия) составили почти половину выделенных культур (48,0 %), при этом удельный вес таких культур среди энтеробактерий, выделенных из мочи, был несколько выше, чем из респираторного тракта (47,4 и 42,9 % соответственно).
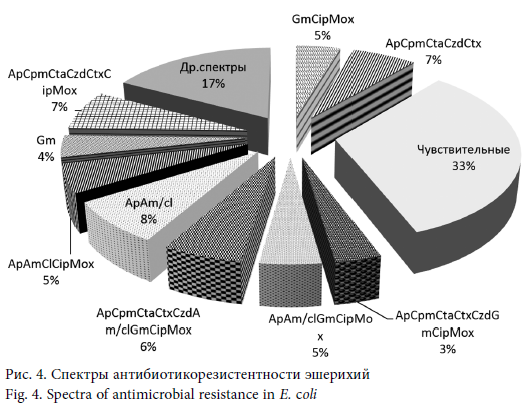
Всего у энтеробактерий было выявлено 26 спектров антибиотикорезистентности, наиболее распространенными среди них была одновременная устойчивость к ApAm/Cl (7,9 %) и к ApCtxCpmCzdCtaCipMox (7,3 %). Несколько реже встречались наборы детерминант резистентности к ApCtxCpmCzdCta (6,6 %), ApAm/ClCipMox и ApAm/Cl CtxCpmCzdCtaGmCipMox (по 5,3 %), ApAm/ClGmCipMox и GmCipMox (по 4,6 %). В целом штаммы с девятью спектрами, представленными на рис. 4, вместе составили почти половину изученных культур (49,7 %). Остальные 17 спектров были представлены единичными изолятами и составили вместе менее пятой части изученных штаммов (17,2 %).
ВЫВОДЫ:
1. Среди эшерихий, выделенных у пациентов многопрофильного стационара, превалировали антибиотикорезистентные культуры с высоким удельным весом полирезистентных штаммов (48,0 %).
2. Наибольшую активность в отношении эшерихий проявляли карбапенемы, особенно имипенем, к которому не было выявлено устойчивых культур. Сохраняли активность также фосфомицин, к которому было выявлено только два устойчивых штамма, амикацин и комбинация цефоперазон / сульбактам.
3. Появление в стационаре штаммов эшерихий, устойчивых к карбапенемам, является опасным прогностическим признаком, подтверждающим неблагоприятную глобальную тенденцию распространения устойчивости к карбапенемам.
4. Вариабельность устойчивости энтеробактерий к антимикробным препаратам и появление опасных для распространения генов резистентности штаммов подтверждает необходимость проведения постоянного мониторинга антибиотикорезистентности микроорганизмов с анализом механизмов их устойчивости.
Об авторах
Надежда Сергеевна Козлова
ГБОУВО «Северо-западного государственного медицинского университета им. И.И. Мечникова»
Автор, ответственный за переписку.
Email: spbkns@gmail.com
канд. мед. наук, доцент, доцент кафедры медицинской микробиологии Россия
Наталья Евгеньевна Баранцевич
ФГБУ «Северо-Западного федерального медицинского исследовательского центра им. В. А. Алмазова»
Email: lenabara2003@inbox.ru
младший научный сотрудник научно-исследовательской лаборатории внутрибольничных инфекций Россия
Елена Петровна Баранцевич
ФГБУ «Северо-Западного федерального медицинского исследовательского центра им. В. А. Алмазова»
Email: lenabara2003@inbox.ru
д-р мед. наук, заведующая научно-исследовательской лабораторией внутрибольничных инфекций Россия
Список литературы
- Antimicrobial resistance: global report on surveillance 2014. World Health Organization. Geneva; 2014: 232.
- Сидоренко С.В. Микроорганизмы семейства Enterobacteriaceae: клиническое значение и этиотропная терапия // Consilium Medicum. — 2004. — Т. 6, № 1. — С. 23–26. [Sidorenko SV. Mikroorganizmy semeystva Enterobacteriaceae: klinicheskoe znachenie i etiotropnaya terapiya. Consilium Medicum. 2004;6(1):23-26. (In Russ).]
- Козлов Р.С., Голуб А.В. Выбор антимикробных препаратов при неосложненных инфекциях мочевых путей: как принять соломоново решение? // Клиническая микробиология и антимикробная химиотерапия. – 2014. – Т.16. — №1. –- С.18–25. [Kozlov RS, Golub AV. Choice of Antimicrobial Agents in Uncomplicated Urinary Tract Infections: How to Make Decision Worthy of Solomon? Klinicheskaja mikrobiologija i antimikrobnaja himioterapija. 2014;16(1):18-25. (In Russ).]
- Косякова К.Г., Каменева О.А., Морозова С.Е. Микробный пейзаж и уровень антибиотикорезистентности в отделении реанимации новорожденных // Профилактическая и клиническая медицина. — 2015. — № 2. — С. 12–17. [Kosjakova KG, Kameneva OA, Morozova SE. Microbial landscape and the levelof antibiotic resistance in the neonatal intensive care unit. Preventive andclinical medicine. 2015;2 (55):12-17. (In Russ).]
- Решедько Г.К., Рябкова Е.Л, Кречикова О.И., и др. Резистентность к антибиотикам грамотрицательных возбудителей нозокомиальных инфекций в ОРИТ многопрофильных стационаров России // Клиническая микробиология и антимикробная химиотерапия. — 2008. — Т. 10. — № 2. — С. 96–112.
- [Reshed’ko GK, Rjabkova EL, Krechikova OI, et al. Antimicrobial Resistance Patterns of Gramnegative Nosocomial Pathogens in Russian ICUs. Klinicheskaja mikrobiologija i antimikrobnaja himioterapijaerapy. 2008;10(2):96-112. (In Russ).]
- Решедько Г.К., Щебников А.Г., Морозов М.В., и др. Escherichia coli как возбудитель нозокомиальных инфекций в ОРИТ // Клиническая микробиология и антимикробная терапия. — 2011. — Т. 13. — № 4. — С. 314–321. [Reshed’ko GK, Shhebnikov AG, Morozov MV, et al. Escherichia coli as a nosocomial pathogen ICUs. Klinicheskaja mikrobiologija i antimikrobnaja ¬himioterapijaerapy. 2011;13(4):314-321. (In Russ).]
- Руднев В.А., Бельский Д.В., Дехнич А.В. Инфекции в ОРИТ в России: результаты национального многоцентрового исследования // Клиническая микробиология и антимикробная химиотерапия. — 2011. — Т. 1. — № 4. — С. 294–303. [Rudnev VA, Bel’skij DV, Dehnich AV. Infection in Russian ICUs: ¬results of the nationwide multicenter study. Klinicheskaja mikrobiologija i antimikrobnaja himioterapijaerapy. 2011;13(4):294-303. (In Russ).]
- Сухорукова М.В., Эйдельштейн М.В., Склеенова Е.Ю., и др. Антибиотикорезистентность нозокомиальных штаммов Enterobacteriaceae в стационарах России: результаты многоцентрового эпидемиологического исследования МАРАФОН в 2011–2012 гг. // Клиническая микробиология и антимикробная химиотерапия. — 2014. — Т. 16. — № 4. — С. 254–265. [Suhorukova MV, Jejdel’shtejn MV, Skleenova EJ, et al. Antimicrobial resistance of nosocomial Enterobacteriaceae isolated in Russia: results of the national multicenter surveillance study «MARATHON» 2011–2012. Klinicheskaja mikrobiologija i antimikrobnaja himioterapijaerapy. 2014;16(4):254-265. (In Russ).]
- Стратегия и тактика применения антимикробных средств в лечебных учреждениях России. Российские национальные рекомендации. — М., 2012. — 92 c. [Strategiya i taktika primeneniyaantimikrobnykh sredstv v lechebnykh uchrezhdeniyakh Rossii. Rossiyskie natsional’nye rekomendatsii. Moscow; 2012:92. (In Russ).]
- Пестова Н.Е., Баранцевич Е.П., Рыбкова Н.С., и др. Изучение эффективности применения метода секвенирования ДНК по фрагменту гена 16s рРНК для идентификации микроорганизмов // Профилактическая и клиническая медицина. — 2011. — № 4. — С. 57–59. [Pestova NE, Barantsevich EP, Rybkova NS, et al. Izuchenie effektivnosti primeneniya metoda sekvenirovaniya DNK po fragmentu gena 16s rRNK dlya identifikatsii mikroorganizmov. Profilakticheskaya i klinicheskaya meditsina. 2011;(4):57-59. (In Russ).]
- EUCAST-(2013) — [Электронный ресурс] — Режим доступа: http://www.eucast.org/clinical_breakpoints/
- Гланц C. Медико-биологическая статистика: пер. с англ. — М.: Практика, 1999. [Glantz C. Primer of ¬Biostatistics. Moscow: Praktika; 1999. (In Russ).]
- Barantsevich EP, Churkina IV, Barantsevich NE, et al. emergence of Klebsiella pneumoniae producing NDM-1 carbapenemase in Saint Petersburg, Russia //
- J Antimicrob Chemother. 2013;68(5):1204-6.
- doi: 10.1093/jac/dks503. Epub 2013 Jan 12.
- Егорова С.А., Кафтырева Л.А., Липская Л.В., и др. Штаммы энтеробактерий, продуцирующие бета-лактамазы расширенного спектра и металлобета-лактамазу NDM-1, выделенные в стационарах в странах Балтийского региона // Инфекция и иммунитет. — 2013. — Т. 3, № 1. — С. 29–36. [Egorova SA, Kaftyreva LA, Lipskaja LV, et al. Enterobacteriacae, producing ESBLs and metallo-β-lactamase NDM-1, isolated in hospitals of Baltic region countries. Infekcija i immunitet. 2013;3(1):29-36. (In Russ).]
- Галкин Д.В. Карбапенемы через 20 лет после открытия: современные микробиологические и клинические аспекты // Клиническая микробиология и антимикробная химиотерапия. — 2007. — Т. 9. — № 2. — С. 133–152. [Galkin DV. A 20-Year History of Carbapenems: Current Microbiological and Clinical Aspects. Klinicheskaja mikrobiologija i antimikrobnaja himioterapija.2007;9(2):133-152. (In Russ).]
- Antimicrobial resistance surveillance in Europe Annual report of European Antimicrobial resistance surveillance network (EARS-net), 2011. Stockholm: ECDC; 2012. 79 p.
- European centre for disease prevention and control, european medicines agency. The bacterial challenge: time to react ECDC/EMEA joint technical report. Stockholm: ECDC; 2009. 42 p.
- Козлов Р.С. Селекция резистентных микроорганизмов при использовании антимикробных препаратов: концепция «параллельного ущерба» // Клиническая микробиология и антимикробная химиотерапия. — 2010. — №12. — С. 284–94. [Kozlov RS. Selection of resistance associated with the use of antimicrobial agents: collateral damage concept. Klinicheskaja mikrobiologija i antimikrobnaja himioterapija. 2010; (12):284-94. (In Russ).]
- European centre for disease prevention and control. Risk assessment on the spread of carbapenemase-producing Enterobacteriae (CPE) through patient transfer between healthcare facilities? With special emphasis on cross-border transfer. Stockholm: ECDC; 2011. 63 p.
- Научный отчёт о результатах многоцентрового исследования этиологии и антибиотикорезистентности энтеробактерий — возбудителей осложненных интраабдоминальных инфекций в России. Научно-исследовательский институт антимикробной химио¬терапии. — Смоленск, 2010. [Nauchnyy otchet o rezul’tatakh mnogotsentrovogo issledovaniya etiologii i antibiotikorezistentnosti enterobakteriy – vozbuditeley oslozhnennykh intraabdominal’nykh infektsiy v Rossii. Nauchno-issledovatel’skiy institut antimikrobnoy khimioterapii. Smolensk, 2010. (In Russ).]
Дополнительные файлы








