ПРИМЕНЕНИЕ МЕТОДОВ СКАНИРУЮЩЕЙ (АТОМНО-СИЛОВОЙ И ЭЛЕКТРОННОЙ) МИКРОСКОПИИ В НАНОГИСТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЯХ (на примере преэклампсии)
- Авторы: Павлова Т.В.1, Павлова Л.А.1, Петрухин В.А.2, Пилькевич Н.Б.1, Селиванова А.В.3, Сырцева И.С.3, Каплин А.Н.4
-
Учреждения:
- Федеральное государственное автономное образовательное учреждение высшего образования «Белгородский государственный национальный исследовательский университет»
- Московский областной научно-исследовательский институт акушерства и гинекологии
- Белгородская областная клиническая больница Святителя Иоасафа
- Курский государственный медицинский университет
- Выпуск: Том 25, № 1 (2017)
- Страницы: 6-13
- Раздел: Морфология и патологическая анатомия
- Статья получена: 31.03.2017
- Статья одобрена: 31.03.2017
- Статья опубликована: 31.03.2017
- URL: https://journals.eco-vector.com/pavlovj/article/view/6127
- DOI: https://doi.org/10.23888/PAVLOVJ201716-13
- ID: 6127
Цитировать
Полный текст
Аннотация
Ключевые слова
Полный текст
Антенатальная охрана плода - одна из наиболее актуальных задач перинатологии, тесно связанная с проблемами снижения перинатальной заболеваемости и смертности, частота которых в значительной степени зависит от экстрагенитальных заболеваний матери, функции плаценты, характера течения беременности, осложнений родов [1. 2]. Несмотря на многолетнее изучение, пре-эклампсия по-прежнему остается серьезной проблемой, обусловленной тяжелыми последствиями этого заболевания [3-6]. Инновационные методы в патоморфологии делают возможным получение новых данных для решения клинических вопросов профилактики и коррекции преэклампсии [7-9]. В связи с этим, целью настоящего исследования явилось изучение эритроцитов женщин, беременность которых осложнена преэклампсией с помощью атомно-силовой и электронной сканирующей микроскопии.
Материалы и методы
В работе использован клинический материал обследования пациенток, беременность у которых осложнялась преэк-лампсией с умерено выраженным (50 женщин) и тяжелым (30 женщин) течением (основная группа). Контрольную группу составили 20 беременных. Проводилось изучение акушерского анамнеза, сопутствующей экстрагенитальной патологии, течения беременности и родов. Исследование морфологических свойств эритроцитов выполнено при помощи гемосканирования, эритроцитометрии и элементного анализа форменных элементов крови и проводились в растровом микроскопе «FE1 Quanta 200 3D». Кровь на исследование брали из вены в количестве 2,5±0,5 мл.
Нами была проведена зондовая и электронная сканирующая микроскопия эритроцитов с использованием больших полей сканирования с выполнением топографии поверхности и их морфометрии. При исследовании в электронном микроскопе были изучены различные формы эритроцитов в зависимости от их поверхностной архитектоники и размеров.
Элементный анализ кислорода, осуществляли с использованием детектора для регистрации спектров характеристического рентгеновского излучения фирмы EPAX, которые были интегрированы с растровым электронным микроскопом «Quanta 600 FEG». Помимо этого, проведено изучение тканей с применением атомно-силового микроскопа «Ntegra-Aura». Обработку и построение АСМ-изображений проводили при помощи программного обеспечения «NOVA» (НТ-МДТ, Россия) и «Image Analysis» (НТ-МДТ, Россия).
Статистическая обработка полученных данных осуществлялась с помощью Microsoft Excel и Statistica 6.0. В целях определения репрезентативности исследования высчитывался коэффициент вариации (V<33%), далее применялся t-критерий Стьюдента для оценки значимости расхождения между средними выборочных совокупностей, была оценена однородность исследуемых совокупностей на основе коэффициента вариации.
Результаты и их обсуждение
Результаты гемосканирования показали, что у женщин с преэклампсией эритроциты имели склонность к стазу, сладж-феномену и тромбозу. Основная часть клеток была представлена дискоцитами (89.71 ± 2,35 в контрольной группе, 75,50±1,25 при преэклампсии умерено выраженной и 72,50±2,31 - тяжелой). При этом, данный показатель был достоверно выше (р<0,05) в сравнении с группами пациенток без патологии беременности (табл. 1).
Большая часть эритроцитов имела округлую форму. Однако наблюдались клетки вытянутой формы, что может свидетельствовать как о нарушении эластичности мембран, так и затруднении прохождения через микроциркуляторное русло в связи с изменением его строения. Увеличивалось содержание цитоплазматических мостиков между клетками, что способствовало в дальнейшем тромбозу сосудов. Происход и-ло нарушение строения плазматических мембран клеток. Изменялась архитектоника плазматических отростков.
Таблица 1 Изменения формы эритроцитов у беременных женщин с преэклампсией
Морфологические формы эритроцитов | Контрольная группа (20) | Преэклампсия умерено выраженная (50) | Преэклампсия тяжелая (30) |
Дискоциты (%) | 89,71±2,35 | 70,61±2,44* | 62.67±2,01** |
Обратимо измененные (переходные) (%) | 10,00±1,46 | 19,06±2,35* | 21,00±2,31** |
Необратимо измененные: (предгемолитические) (%) | 0,15±0,16 | 6,19±1,10* | 10,11±1,67** |
Дегенеративные формы (%) | 0,15±0,15 | 4,15±0,56* | 7,23±0,82** |
* р<0,05 в сравнении с контрольной группой
** р<0,05 в сравнении между группами с преэклампсией различной степени тяжести
Нами показано, что содержание мик-роцитов при преэклампсии средней степени тяжести (18,20±1,41%) было достоверно выше в сравнении с контрольной группой (14,30±1,52%) (р<0,05) (табл. 2). Наблюдалась тенденция к уменьшению их содержания при тяжелом течении заболевания. Содержание макроцитов прогрессивно возрастало (р<0,05) по мере увеличения тяжести заболевания (1,40±0,14%, 6,30±0,14% и 15,30±1,15%). Диаметр нормоцитов, макроцитов и микроцитов достоверно не отличался от контрольной группы.
Таблица 2. Соотношение видов эритроцитов у беременных без патологии и с преэклампсией
Соотношение размеров эритроцитов | Контрольная группа (20) | Преэклампсия умерено выраженная (50) | Преэклампсия тяжелая (30) |
Микроциты (%) | 14,30±1,52 | 18,20±1,41* | 12,20±1,50* |
Нормоциты (%) | 84,30±1,41 | 75,50±1,25* | 72,50±2,31* |
Макроциты (%) | 1,40±0,14 | 6,30±0,14* | 15,3 0± 1,15 * |
* р<0,05 в сравнении с контрольной группой
Содержание переходных форм эритроцитов достоверно увеличивалось по мере возрастания тяжести заболевания (19.06 ± 2,35% и 21,00±2,31%) по сравнению с группой практически здоровых беременных (10,00±1,46%) (р<0,05) (табл. 1). Так, число элепсовидных клеток было 3,06±1,05% при преэклампсии средней тяжести и 4,00 ± 0.09% - тяжелой. Последний показатель достоверно выше (р<0,05), чем в контрольной группе (2,50±0,08%). Дискоциты с гребнем составляли при осложненной беременности: 2,40±0,30% и 2,80±0,30% (1,00 ± 0,09%) (р<0,05), клетки в виде плоских дисков -3,60±0,85% и 4,00±0,09% (1,00 ± 0,30%) (р<0,05), дискоциты с выростом -2,50±0,35% и 2,40±0,30% (1,40±0,04%) (р<0,05), дискоциты с множественными выростами - 4,50±1,05% и 4,60±0,08 % (2,60±0,31 %) (р<0,05), эритроциты в виде «тутовой ягоды» - 3,00±0,45% и 3,2±2,39% (0,50±2,39%) (р<0,05).
Еще в большей степени, прогрессировало содержание необратимо измененных (предгемолитических) клеток (0,15±0,16%, 6,19±1,10% и 10,11±1,67%) (р<0,05). Так, если в контрольной группе куполообразные клетки практически не встречались, то при преэклампсии в зависимости от тяжести состояния они составляли соответственно 1,40±0,04% и 3,50±0,50% (р<0,05). Аналогичная тенденция выявлена при исследовании сферических форм эритроцитов (1,60 ±
0,28% и 4,50±1,30%) (р<0,05). Если в контрольной группе наблюдались единичные клетки в виде «спущенного мяча», то при патологии беременности их величина возрастала до 2,19±0,15% и 4,11±1,20% (р<0,05). При преэклампсии резко возрастало содержание дегенеративных форм эритроцитов (0,15±0,15%, 4.15±0,56% и 7,23±0,82%) (р<0,05). Все эти виды измененных эритроцитов не подлежат восстановлению. Они относятся к группе необратимо деформированных или предгемолити-ческих. Возрастал уровень разрушенных эритроцитов (рис. 1. 2. 3).
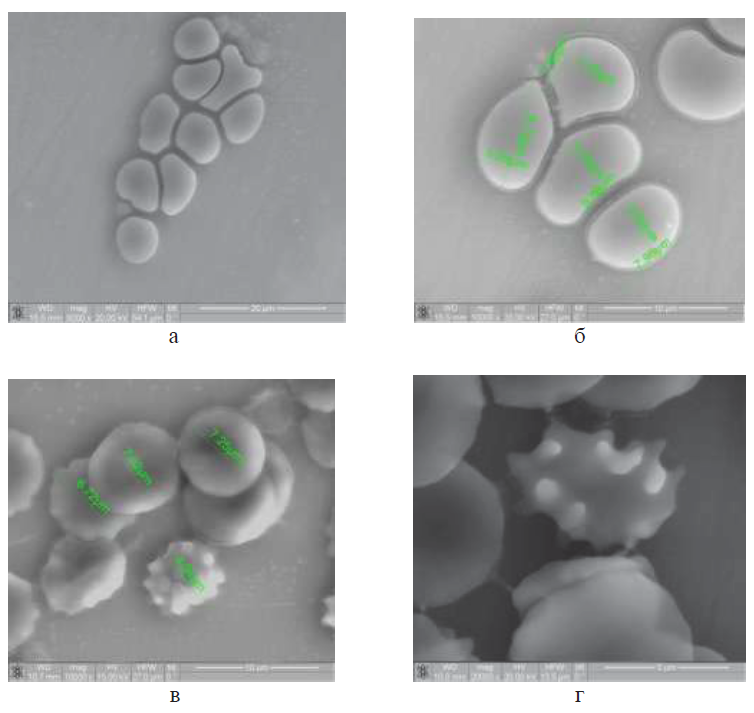
Рис. 1. Эритроциты крови у беременных женщин с умерено выраженной преэклампсией РЭМ. рис. а (х5000), рис. б (х10000), рис. в (10000), рис. г (х20000)
Клетки в состоянии стаза, сладжа и начала тромбоза. Дискоциты в виде неправильного овала или с нарушенной формой. Наблюдаются нормоциты, макроциты, микроциты. Содержание клеток с выростами уменьшено. Кривизна центрального углубления различна, как и его глубина. Выявлены необратимо измененные (предгемо-литические) эритроциты в виде сферы и «спущенного мяча». Содержание цитоплазматических мостиков между клетками увеличено.
При изучении поверхности эритроцитов с помощью атомно-силовой микроскопии было показано, что глубина впадины дискоцитов подсчитанная с помощью изучения профиля клетки в среднем составляла 0.30±0,07 цм, 0,40±0,05 цм, что значительно отличалось от контрольной группы (0.25±0,06 цм) (р<0,05). При изучении соотношения диаметра эритроцита к диамет- 16±2 и 14±1 единиц (21±2 в контрольной ру впадины данная величина составляла группе) (р<0,05) (табл. 3).
Таблица 3. Поверхность неизмененных эритроцитов (зондовая микроскопия) (100% — все эритроциты)
Размеры эритроцитов | Контрольная группа (20) | Преэклампсия умерено выраженная (50) | Преэклампсия тяжелая (30) |
Глубина впадины дискоцитов (цм) | 0,25±0,06 | 0,30±0,07 | 0,40±0,05 |
21±2 | 16±2 | 14±1 |
* р<0,05 в сравнении между группами с преэклампсией различной степени тяжести
** р<0,05 в сравнении с контрольной группой
При изменении нормальной дискои дальной формы на поверхности эритроцитов, наряду с такими структурами, формировались более крупные выступы. Строение пор было нарушено во всех группах - (рис. 2).
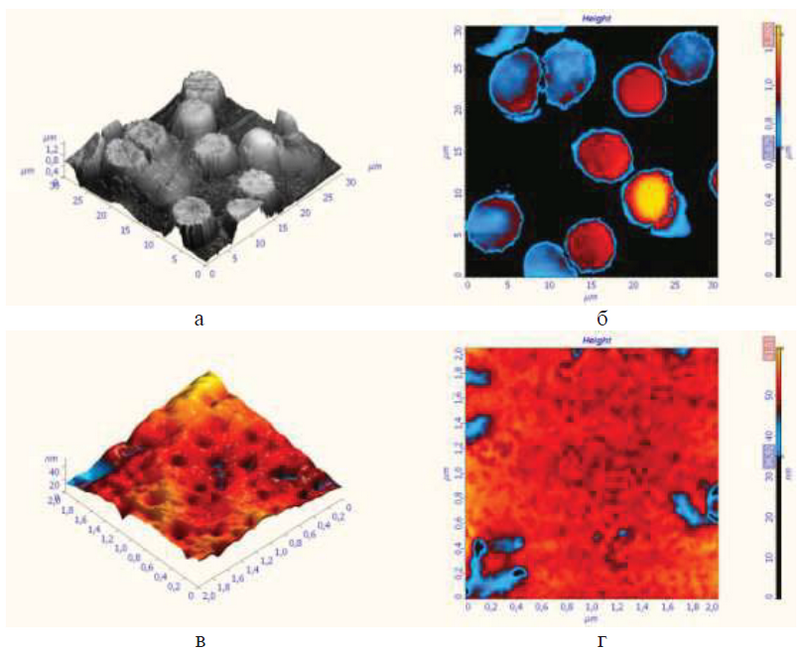
Рис. 2. Эритроциты крови у беременных женщин с тяжелой формой преэклампсии. Дискоциты в форме неправильного овала (а, б). Кривизна и глубина центрального углубления изменена. Наблюдаются клетки куполооблазные, в виде сферы и «спущенного мяча». Начало гемолиза клеток (а, б). Строение пор на поверхности эритроцитов нарушено (в, г). Атомно-силовая микроскопия. (рис. а, б - трехмерная гистограмма; рис. в, г - двухмерная гистограмма)
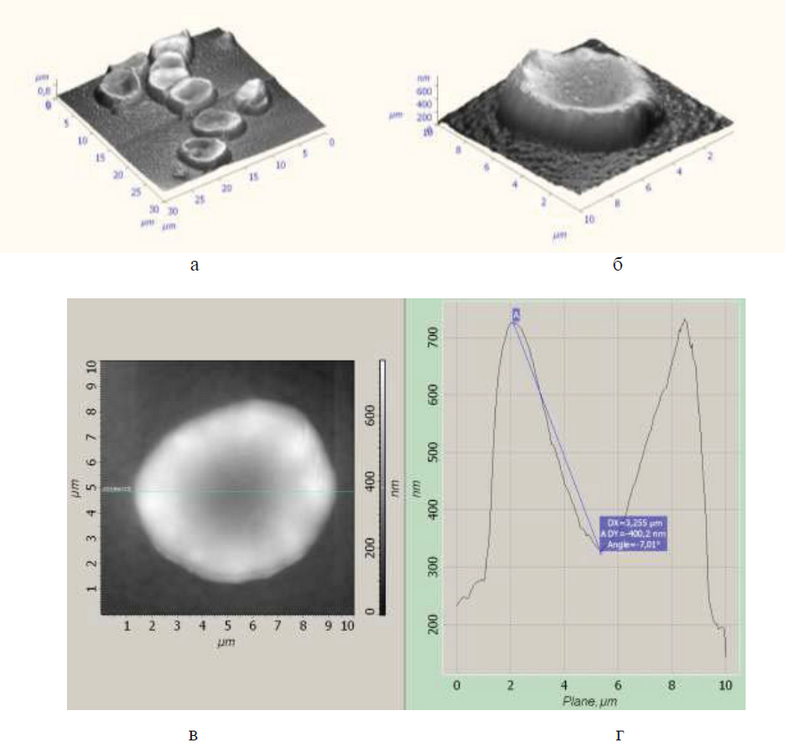
Рис. 3. Эритроциты крови у беременных женщин с тяжелой формой преэклампсии. Дискоциты в форме неправильного овала (а, б, в). Кривизна и глубина центрального углубления изменена. Атомно-силовая микроскопия. (рис. а, б - трехмерная гистограмма; рис. в - двухмерная гистограмма, г - графическое изображение размеров эритроцита)
Таблица 4. Содержание кислорода в эритроцитах внутри сосудов ворсин (пропорциональное содержание атомов микроэлемента в % от общего числа содержания атомов в эритроците)
Элемент | Контроль | Преэклампсия умерено выраженная | Преэклампсия тяжелая |
O | 24, 25±2,31 | 17,51±2,03* | 15,42±2,65** |
Всего | 100 | 100 | 100 |
* р<0,05 по сравнению с практически здоровыми беременными женщинами
** р<0,05 по сравнению с пациентами с преэклампсией
При изучении содержания кислорода в эритроцитах было выявлено, что содержание кислорода внутри эритроцитов в основной группе было статистически достоверно ниже, чем в контрольной группе, а в процентном соотношении эта разница составила 18%.
Выводы
- С помощью сканирующей электронной и атомно-силовой микроскопии проведен обзор и анализ результатов исследования трехмерных форм эритроцитов при преэклампсии различной тяжести. Показано, что форма эритроцита является диагностическим индикатором заболевания.
- Содержание переходных форм эритроцитов достоверно увеличивалось по мере возрастания тяжести преэклампсии. Еще в большей степени, прогрессировало содержание необратимо измененных (предгемолитических) клеток. Возрастал уровень разрушенных эритроцитов.
- Структура плазмолеммы клеток была нарушена. Изменялась архитектоника плазматических отростков. Нарушалось строение пор плазмолеммы клеток. Увеличивалось содержание цитоплазматических мостиков между клетками, что способствовало стазу, сладжированию и тромбозу.
- Отмечено изменение степени двоя-ковогнутости нормальных эритроцитов. Глубина впадины дискоцитов, подсчитанная с помощью изучения профиля клетки значительно отличалось от контрольной группы, как и соотношения диаметра эритроцита к диаметру впадины.
- Содержание кислорода внутри эритроцитов в группе преэклампсии было статистически достоверно ниже на 18%, чем в контрольной группе.
Конфликт интересов отсутствует.
Об авторах
Т. В. Павлова
Федеральное государственное автономное образовательное учреждениевысшего образования «Белгородский государственный национальный исследовательский
университет»
Автор, ответственный за переписку.
Email: pavlova@bsu.edu.ru
д.м.н., проф., зав. кафедрой патологии Россия
Л. А. Павлова
Федеральное государственное автономное образовательное учреждениевысшего образования «Белгородский государственный национальный исследовательский
университет»
Email: lpavlova@bsu.edu.ru
д.м.н., проф. кафедры патологии Россия
В. А. Петрухин
Московский областной научно-исследовательский институт акушерства и гинекологии
Email: 1akmoniiag@mail.ru
д.м.н., проф., руководитель I акушерской клиники Россия
Н. Б. Пилькевич
Федеральное государственное автономное образовательное учреждениевысшего образования «Белгородский государственный национальный исследовательский
университет»
Email: pilkevich@bsu.edu.ru
д.м.н., проф. кафедры патологии Россия
А. В. Селиванова
Белгородская областная клиническая больница Святителя Иоасафа
Email: okb@bel.ru
врач акушер-гинеколог перинатального центра Россия
И. С. Сырцева
Белгородская областная клиническая больница Святителя Иоасафа
Email: innessita25@mail.ru
врач анестезиолог-реаниматолог
РоссияА. Н. Каплин
Курский государственный медицинский университет
Email: drkaplin@rambler.ru
ассистент кафедры патологической анатомии Россия
Список литературы
- Сюндюкова Е.Г., Медведев Б.И., Сашенков С.Л., Зайнетдинова Л.Ф., Канай-кина А.Ю. Гистоморфологические особенности плаценты при преэклампсии // Медицинский вестник Башкортостана. 2014. Т. 9, №5. С. 104-107.
- Павлова Т.В., Петрухин В.А., Сумин С.А., Селиванова А.В., Сырцева И.С. Гемо-реологические особенности маточноплацентарного кровотока при тяжелом гесто-зе // Архив патологии. 2014. №3. С. 37-40.
- Павлова Т.В., Куликовский В.Ф., Павлова Л.А. Клиническая и экспериментальная морфология. М.: ООО «Медицинское информационное агентство», 2016. 256 с.
- Brewer J., Owens M.Y., Wallace K., Reeves A.A., Morris R., Khan M. et al. Posterior reversible encephalopathy syndrome in 46 of 47 patients with eclampsia // Am. J. Ob-stet. Gynecol. 2013. Vol. 208, №6. Р. 1-6.
- Muralimanoharan S., Maloyan A., Mele J., Guo C., Myatt L.G., Myatt L. MIR-210 modulates mitochondrial respiration in placenta with preeclampsia // Placenta. 2012. Vol. 33. Р. 23-816.
- Wortelboer E.J., Koster M.P., Cuckle H.S., Stoutenbeek P.H., Schielen P.C., Visser G.H. First-trimester placental protein 13 and placental growth factor: markers for identification of women destined to develop early-onset preeclampsia // Br. J. Obstet. Gynaecol. 2010. Vol. 117, №11. Р. 9-1384.
- Gao W.L., Liu M., Yang Y., Yang H., Liao Q., Bai Y. et al. The imprinted H19 gene regulates human placental trophoblast cell proliferation via encoding miR-675 that targets Nodal Modulator 1 (NOMO1) // RNA Biol. 2012. Vol. 9, №7. Р. 1000-1002.
- Pavlova T., Malutina E., PetrukhinV., Nesterov A., Bashuk I., Kolesnikov D. et al. Use of methods of scanning microscopy at pathology of placenta // Virchows Archiv. 2015. Vol. 467 (Suppl 1). Р. 141-143.
- Hafner E., Metzenbauer M., Stumpflen I., Waldhor T. Measurement of placental bed vascularization in the first trimester, using 3D-power-Doppler, for the detection of pregnancies at-risk for fetal and maternal complications // Placenta. 2013. Vol. 34, №10. Р. 888-892.
Дополнительные файлы











