Транскрипционная активность генов, участвующих в регуляции диапаузы колорадского жука, и ее изменения под влиянием инсектицида фипронила
- Авторы: Никоноров Ю.М.1, Сыртланова Л.А.1, Китаев К.А.2, Беньковская Г.В.1
-
Учреждения:
- ФГБУН «Институт биохимии и генетики» Уфимского научного центра РАН
- ФГБУ «Башкирский референтный центр» Россельхознадзора
- Выпуск: Том 14, № 3 (2016)
- Страницы: 56-63
- Раздел: Статьи
- Статья получена: 14.11.2016
- Статья опубликована: 15.09.2016
- URL: https://journals.eco-vector.com/ecolgenet/article/view/5483
- DOI: https://doi.org/10.17816/ecogen14356-63
- ID: 5483
Цитировать
Полный текст
Аннотация
Исследованы особенности транскрипционной активности генов, принимающих участие в регуляции диапаузы у имаго колорадского жука в лабораторных условиях, на стадии подготовки к зимней диапаузе и в середине зимнего периода. В гонадах остающихся активными особей, в отличие от особей, находящихся в состоянии покоя, установлено наличие мРНК гена субъединицыrdl рецептора GABA-А. Выявлено повышение содержания мРНК генов DP1, fer, DAT1, DAT2, EcR, Ldace-1 в середине периода зимней диапаузы в тканях мышц и гонад особей, перенесших действие фипронила, неконкурентного ингибитора ионотропного канала, образованного рецептором GABA-A. Выдвинуто предположение о том, что фипронил, блокируя связывание GABA с рецептором, тем самым оказывает существенное влияние на регуляторные процессы, сопровождающие развитие диапаузных состояний.
Ключевые слова
Полный текст
Введение
Успех исследований генетической основы адаптациогенеза во многом зависит от выбранного объекта, и мы полагаем, что такой моделью может служить широко известный вид насекомого-фитофага — колорадский картофельный жук Leptinotarsa decemlineata Say [1]. Для этого вида характерна не только способность к быстрому формированию устойчивости к инсектицидам, обеспеченная высоким уровнем генетического полиморфизма, но и значительный уровень полифенизма в отношении форм покоя — диапаузных состояний [2, 3]. Для вида установлено наличие сезонных форм покоя, запрограммированных и обусловленных фотопериодической реакцией (проспективная диапауза), а также способность к быстрому развитию диапаузного состояния при резком неожиданном изменении условий, в частности при интенсивном воздействии инсектицидов — конзекутивная диапауза.
Формирование диапаузы у насекомых может проходить с участием нескольких различных механизмов, что выражается как разнообразие экспрессионных профилей генов, ассоциируемых с диапаузными состояниями у разных видов насекомых [3, 4]. Мониторинг экспрессии ряда генов, в число которых входят гены, кодирующие запасные белки (DP1), белки, обеспечивающие устойчивость к отдельным неблагоприятным факторам среды (DAT2, DAT3), позволил установить глубину диапаузных состояний в популяциях колорадского жука на территории Северной Америки [3]. Такие данные дают основание для долгосрочного прогноза развития и динамики численности популяций и, соответственно, для выбора стратегии и тактики контроля численности фитофага.
Наступление глубокого длительного покоя в период зимней гибернации у колорадского жука предваряется периодом репродуктивной диапаузы. Как в природных условиях, так и в лабораторных культурах у взрослых насекомых может сохраняться двигательная активность, у колорадского жука даже отмечено неоднократное спаривание, однако откладка яиц не наступает. Наши исследования [5] показали, что для популяций колорадского жука на территории Южного Урала наступление репродуктивной диапаузы у самок характеризуется остановкой развития ооцитов на стадии превителлогенеза, несмотря на присутствие в семяприемниках запаса спермы.
В лабораторных условиях на протяжении зимнего периода имаго способны формировать диапаузное состояние, при котором прекращается питание и снижается подвижность, т. е. внешние поведенческие реакции соответствуют фазе поддержания диапаузы [2, 3, 6]. Регуляция индукции диапаузы у L. decemlineata осуществляется с преимущественным вкладом фоторецепторной сигнальной системы [2]. Неотъемлемой частью фоторецепторной системы являются рецепторы гамма-аминомасляной кислоты (ГАМК, GABA). Кодирующие их субъединицы гены экспрессируются в органах зрения и в соответствующих зонах центральной нервной системы у всех животных, в том числе и у насекомых [7]. Можно предположить, что у насекомых, жизнь которых регулируется рядом фотопериодических реакций, экспрессия генов, кодирующих компоненты этих рецепторов, возможна не только в фоторецепторных органах, но и в тканях органов, для которых фотопериодический сигнал определяет переход от одного состояния к другому. Нас интересует, имеет ли отношение ГАМК-сигнальная система к регуляции репродуктивной диапаузы у колорадского жука. Для ответа на этот вопрос мы выясняли, как меняется транскрипционная активность генов, участвующих в регуляции диапаузы — запасных белков DP1и ферритина fer [8], белков, ответственных за устойчивость в период диапаузы (DAT1, DAT2), гена рецептора экдизона, регулирующего репродуктивные процессы (EcR), гена, кодирующего фермент ацетилхолинэстеразу (Ldace-1), активность которой характеризует функциональное состояние нейроэндокринной системы насекомых, и гена rdl, кодирующего субъединицу Rdl — компонент рецептора GABA, участвующего в передаче фотосигнала в тканях гонад и мышцах имаго в период инициации диапаузы (ИД) и в середине января, когда у большинства насекомых определяется фаза поддержания диапаузы (ПД). Кроме того, проведено сравнение между контрольными группами самок и самцов и группами особей, в конце сентября перенесших топикальную обработку сублетальной дозой фипронила, неконкурентного ингибитора ионотропного канала, образованного рецептором GABA типа А, связывающегося с аллостерическим сайтом субъединицы Rdl.
Материалы и методы
Лабораторная культура колорадского жука представлена выборкой (общий объем 450 особей) имаго летней генерации 2014 года, собранной на частной плантации картофеля в августе. Насекомых в лабораторных условиях содержали на свежем корме при естественном свете до конца сентября, после чего их поместили в условия полной темноты. Затем в ходе эксперимента с использованием направленного освещения были выделены группы активных и неактивных самок и самцов. Фотосигнал, использованный как фактор инициации таксиса, позволяет выделить в лабораторной культуре группы активных (подвижных) и неактивных (не реагирующих на направленный свет) особей за короткое время — не более 15 минут при яркости 120 лк. Для них (в трехкратной повторности, по 3 особи из каждой группы) определена транскрипционная активность перечисленных генов (оценка числа копий мРНК для каждого гена) относительно референсного гена домашнего хозяйства rp4 [9] методом количественной ПЦР в режиме реального времени [10]. Повторный аналогичный эксперимент проводили в контрольной группе (36 имаго) и в группе особей (38 имаго), обработанных фипронилом в концентрации 0,0001 % (1 мкл/особь, нанесение микрошприцем МШ-1 в выемку на вентральной стороне проторакса), через 4 месяца, в конце января 2015 года.
Выделение РНК проводили на льду из объединенных для трех имаго мышц торакса или гонад, извлеченных и промытых в растворе Рингера, с использованием набора РНК-Экстран («Синтол») в соответствии с протоколом производителя. Оценку активности ацетилхолинэстеразы (АХЭ) по Эллману в гемолимфе, взятой из спинного сосуда имаго, и определение концентрации белка по методу Бредфорда осуществляли для каждой особи в 5 мкл гемолимфы/100 мкл трис-НСl экстрагирующего буфера рН 7,2 по вышеописанным методикам [11]. Статистическую обработку с применением теста Манна – Уитни для оценки значимости различий данных по экспрессии генов между группами особей и критерия Стьюдента для оценки биохимических данных, а также графическую обработку данных проводили с использованием программ Excel. Для удобства сопоставления экспрессии генов на графических иллюстрациях показано не просто рассчитанное относительно референсного гена число копий мРНК (поскольку оно сильно различается для отдельных генов), а отношение расчетного числа копий мРНК в тканях гонад к аналогичному показателю для тканей мышц либо отношение этих показателей между группами, обработанных фипронилом, и необработанных особей.
Результаты и обсуждение
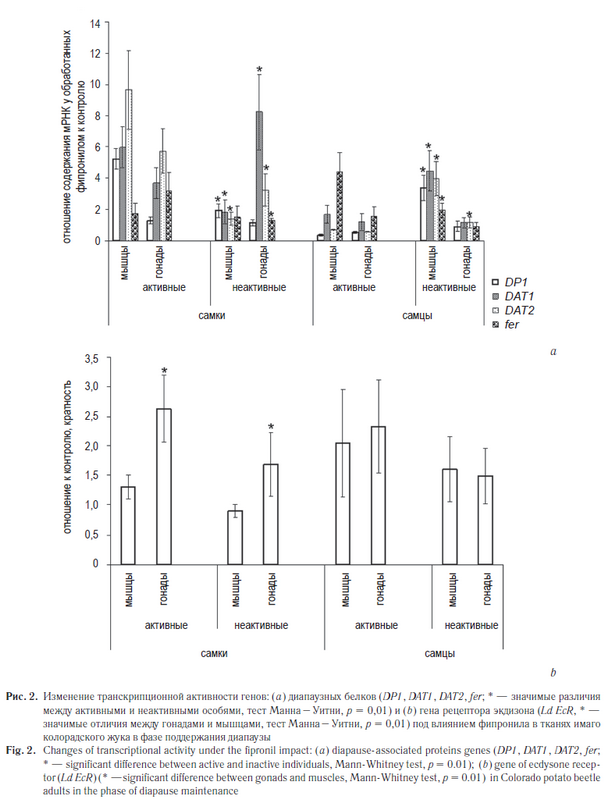
Детальные исследования группы американских ученых под руководством профессора Джорджа Йокума позволили разработать способ определения фазы диапаузного состояния для особей колорадского жука, успешно апробированный на природных популяциях США [3, 6]. Ими предложена таблица по уровню экспрессии нескольких генов, ассоциированных с диапаузой, — генов пищеварительных протеиназ DG1 и DG2 и нескольких запасных белков (DP1, DAT1, DAT2, DAT3). Наши результаты позволяют расширить представление об изменениях в транскрипционной активности генов диапаузных белков и генов, участвующих в регуляции фотопериодической реакции, на разных этапах диапаузы имаго колорадского жука в лабораторных условиях.
К сожалению, полное сопоставление с данными G. Yocum et al. [3, 6] невозможно, поскольку в работе американских коллег не было проведено разделение по полу, а для выделения РНК были использованы тотальные гомогенаты. Тем не менее наши результаты во многом согласуются с результатами этой группы. Содержание мРНК генов DP1, DAT1, DAT2, DAT3 и Ld EcR в гонадах самок и самцов колорадского жука выше, чем в мышечной ткани, и в фазе инициации диапаузы оно повышается относительно референсного гена rp4 в сравнении с активными в данное время особями. Однако копийность мРНК перечисленных выше генов отличается на порядки, и поэтому в качестве показателя, характеризующего транскрипционную активность диапаузирующих и активных особей и в то же время удобного для его графической демонстрации, мы приняли отношение числа копий мРНК в гонадах и мышцах.
Соотношение уровня содержания мРНК гена DP1 в тканях гонад и мышц насекомых, определенного в начале диапаузы, оказалось выше для самок (рис. 1). Согласно определительной таблице наступления фаз диапаузы [3] неактивные самки уже находились к моменту эксперимента в фазе инициации диапаузы, тогда как в остальных группах этот процесс только начинался (у самок) либо еще не начался (у самцов вне зависимости от двигательной активности).

Гены DAT заметно сильнее экспрессированы в гонадах самок, особенно у неактивных особей, вступивших в период формирования диапаузы. Сравнивая наши результаты с предложенной для мониторинга диапаузного состояния таблицей экспрессии генов [3], мы подтвердили то, что проходящие период подготовки к диапаузе особи находились в фазе ИД независимо от степени их активности. В середине периода покоя в соответствии с данными G. Yocum et al. [3, 6] неактивные особи находились в фазе ПД, тогда как у подвижных особей отмечалась незавершенная фаза ИД. Следует отметить, что во всех случаях разница между самками и самцами очень существенна. По-видимому, именно эти различия лежат в основе многообразия паттернов экспрессии генов, ассоциируемых с диапаузой колорадского жука, выявленного ранее [3, 6]. Сопоставление транскрипционной активности генов, ассоциируемых с наступлением диапаузы (рис. 2, а), в группах обработанных фипронилом особей показало повышенное содержание мРНК, особенно заметное у неактивных имаго. Интересные данные получены для гена EcR, не включенного G. Yocum et al. [3, 6] в число ассоциируемых с диапаузой (рис. 2, b). Тест Манна – Уитни позволил выявить достоверное повышение содержания мРНК гена EcR у обработанных особей. Следует подчеркнуть, что для самок в обеих группах отмечено значимо более высокое содержание мРНК в гонадах. Для самцов различия между тканями не были существенными. Усиленная транскрипционная активность в тканях репродуктивных органов позволяет предположить, что такое изменение — компонент стрессового ответа на воздействие ксенобиотика. Сходные изменения экспрессии гена экдизонового рецептора при токсическом стрессе, вызванном действием ряда ароматических инсектицидов, были обнаружены у представителя отряда двукрылых, Chironomus riparius [12, 13]. Фипронил, нарушающий работу всей нейроэндокринной системы не только у насекомых, но и у позвоночных [14–16], способен в малых дозах давать эффекты повышения плодовитости у комнатной мухи [11]. Такое проявление стресс-реакции позволяет считать выявленные нами изменения дифференциальной экспрессии гена EcR закономерным проявлением токсического стресса.
При сравнении реакции на направленное освещение в сентябре в группе самок доля неактивных особей составляла 40,6 %, а в группе самцов — 50 %. В январе в контрольных группах доля неактивных особей достигла 85 %, тогда как среди обработанных фипронилом особей неактивные особи составляли не более 38 %.
При переходе к глубокой диапаузе на фазе ее поддержания интенсивность метаболизма снижается. Меняется тип газообмена, подавляются процессы обмена, секреции и экскреции, снижается интенсивность работы нейроэндокринной системы, что было показано для многих видов насекомых, в том числе и для колорадского жука [4, 17–19]. Признанным маркером этих процессов является активность фермента ацетилхолинэстеразы — важного компонента холинергических синапсов и одновременно участника метаболизма стероидов [20]. Содержание мРНК гена Ldace-1у диапаузирующих особей колорадского жука из контрольных групп также понижено.
Внешние признаки диапаузы у неактивных имаго после обработки фипронилом сохранились, однако при оценке активности ацетилхолинэстеразы у всех обработанных особей зарегистрирована индукция (рис. 3) с превышением значений для контрольных групп в 1,5–5 раз. Транскрипционная активность гена Ldace-1 у этих имаго также превышала значения для контрольных групп. Эти результаты свидетельствуют о повышенной функциональной активности нейроэндокринной системы, что не соответствует представлению о состоянии глубокой диапаузы.

До последнего времени о рецепторах GABA было известно, что в основном они экспрессируются в нейронах оптических долей мозга насекомых [14] аналогично их роли в ЦНС позвоночных [21], принимая участие в циркадианной регуляции нейронной активности. Экспрессия гена rdl в репродуктивных органах имаго колорадского жука, выявленная нами как повышенное содержание мРНК rdl в гонадах активных особей, еще не вступивших в фазу формирования диапаузы (рис. 4, а), резко снижается при переходе к фазе ИД, в сентябре наступившей у неактивных особей. В фазе поддержания диапаузы у активных самцов в гонадах содержание мРНК rdl снижается более чем в 40 раз, у активных самок — в 12 раз, у неактивных особей это снижение не так заметно. Изменения транскрипционной активности гена rdl у особей, обработанных фипронилом, имеют четко выраженные гендерные особенности (рис. 4, b). У самцов отмечено резкое снижение содержания мРНК, тогда как для самок этого не наблюдалось. Эти данные позволяют нам предположить, что такие различия могут быть обусловлены особенностями гормонального баланса самок и самцов, обусловливающими различия в ответе генома на нарушения работы ионных каналов [22].

Снижение транскрипционной активности гена rdl в ответ на действие фипронила может быть вызвано связыванием субъединицы Rdl с фипронилом, сопровождающимся конформационными изменениями рецептора, в результате чего активируется гипотетический супрессор, ингибирующий транскрипцию гена. Эта реакция характерна не только для фипронила. Показано, что и другие ксенобиотики также связываются с субъединицей рецептора, снижая уровень экспрессии как у насекомых, так и у теплокровных [23]. В частности, установлено, что у Anopheles gambiae эта субъединица является мишенью также для пиретроидов и неоникотиноидов [24], а кроме того, отмечено связывание с этим аллостерическим сайтом как у насекомых, так и у теплокровных барбитуратов и стероидов [14, 25]. Полученные результаты позволяют выдвинуть предположение о том, что фипронил, ингибируя связывание GABA с рецептором, тем самым значительно изменяет регуляторные процессы, сопровождающие развитие диапаузных состояний. Повышенная экспрессия целого ряда генов является, по-видимому, компенсаторной реакцией на действие фипронила. Высокая активность АХЭ в гемолимфе у обработанных особей маркирует чрезмерную активность нейроэндокринной системы, не соответствующую состоянию диапаузы. Повышенная транскрипционная активность генов может привести к чрезмерному расходованию энергетических ресурсов и понизить жизнеспособность в период диапаузы, что подтверждается полученными нами ранее данными [26].
Благодарности. Работа поддержана грантом РФФИ № 15-04-04801-а.
Авторы заявляют об отсутствии конфликта интересов.
Об авторах
Юрий Михайлович Никоноров
ФГБУН «Институт биохимии и генетики» Уфимского научного центра РАН
Автор, ответственный за переписку.
Email: nikonorov@anrb.ru
старший научный сотрудник, лаборатория молекулярной биологии и нанобиотехнологии Россия
Лиана Ахнафовна Сыртланова
ФГБУН «Институт биохимии и генетики» Уфимского научного центра РАН
Email: slian4ik@mail.ru
аспирант, лаборатория физиологической генетики Россия
Константин Альбертович Китаев
ФГБУ «Башкирский референтный центр» Россельхознадзора
Email: cordek@ya.ru
энтомолог, лаборатория фитосанитарных исследований Россия
Галина Васильевна Беньковская
ФГБУН «Институт биохимии и генетики» Уфимского научного центра РАН
Email: bengal2@yandex.ru
ведущий научный сотрудник, лаборатория физиологической генетики Россия
Список литературы
- Lehman P, Piironen S, Kankaret M, et al. Photoperiodic effects on diapause-associated gene expression trajectories in European Leptinotarsa decemlineata populations. Insect Mol Biol. 2014;23(5):566-578. doi: 10.1111/jmb.12104.
- Саулич А.Х. Сезонное развитие насекомых и возможности их расселения. — СПб.: Изд-во СПбГУ, 1999. — 248 с. [Saulich AH. The seasonal development of insects and the possibility of resettlement. Saint Petersburg: Izdatelstvo SpbGU; 1999: 248 p. (In Russ.)]
- Yocum GD, Rinehart JP, Larson ML. Monitoring diapause development in the Colorado potato beetle, Leptinotarsa decemlineata, under field conditions using molecular biomarkers. J Insect Physiol. 2011;57(5):645-652. doi: 10.1016/j.jinsphys.2010.11.008.
- Denlinger DL. Regulation of diapause. Ann Rev Entomol. 2002;47:93-122. doi: 10.1146/annurev.ento.
- 091201.145137.
- Беньковская Г.В. Стресс-реакция как механизм реализации адаптивного потенциала особей и популяций насекомых: Дис. … д-ра биол. наук. — Уфа: ИБГ УНЦ РАН, 2008. [Benkovskaya GV. Stress reaction as a mechanism of realization for adaptive potential of individuals and populations of insects. [dissertation]. Ufa: IBG UCS RAS; 2008. (In Russ.)]
- Yocum GD, Rinehart JP, Chirumamilla-Chapara A, Larson ML. Characterization of gene expression patterns during the initiation and maintenance phases of diapause in the Colorado potato beetle, Leptinotarsa decemlineata. J Insect Physiol. 2009;55:32-39. doi: 10.1016/j.jinsphys.2008.10.003.
- Enell L, Hamasaka Y, Kolodziejczyk A, Nässel DR. Gamma-Aminobutyric acid (GABA) signaling components in Drosophila: immunocytochemical localization of GABA(B) receptors in relation to the GABA(A) receptor subunit RDL and a vesicular GABA transporter. J Comp Neurol. 2007;505(1):18-31. doi: 10.1002/cne.21472.
- Pham DQD, Winzerling JJ. Insect ferritins: typical or atypical? Biochim Biophys Acta. 2010;1800(8):824-833. doi: 10.1016/j.bbagen.2010.03.004.
- Shi XQ, Guo WC, Wan PJ, et al. Validation of reference genes for expression analysis by quantitative real-time PCR in Leptinotarsa decemlineata (Say). BMC Research Notes. 2013;6:93. doi: 10.1186/1756–0500–6–93.
- Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-∆∆CT method. METHODS. 2001;25:402-408. doi: 10.1006/meth.2001.1262.
- Беньковская Г.В., Мустафина Р.Ш. Влияние светового режима на биохимические показатели развития стресс-реакции в линиях Musca domestica L. с различной продолжительностью жизни // Журнал эволюционной биохимии и физиологии. — 2012. — Т. 48. — № 5. — С. 433–438. [Benkovskaya GV, Mustafina RSh. Effect of light regime on biochemical parameters of development of stress-reactions of Musca domestica lines with different lifespan. Zhurnal evolyutsionnoi biohimii i physiologii. 2012;48(5):433-438. (In Russ., Eng.)]. doi: 10.1134/S0022093012050027.
- Planello R, Martinez-Guitarte JL, Morcillo G. The endocrine disruptor bisphenol A increases the expression of Hsp70 and ecdysone receptor genes in the aquatic larvae of Chironomus riparius.Chemosphere. 2008;71(10):1870-1876.
- doi: 10.1016/j.chemosphere.2008.01.033.
- Planello R, Herrero O, Martinez-Guitarte JL, Morcillo G. Comparative effect of butyl benzyl phthalate (BBP) and di(2-ethylhexyl) phthalate (DEHP) on the aquatic larvae of Chironomus riparius based on gene expression assays related to the endocrine system, the stress response and ribosomes. Aquat Toxicol. 2011;105(1-2):62-70.
- doi: 10.1016/j.aquatox.2011.05.011.
- Buckingham SD, Biggin PC, Sattelle BM, et al. Insect GABA receptors: splicing, editing, and targeting by antiparasitics and insecticides. Mol Pharmacol. 2005;68:942-951. doi: 10.1124/mol.105.015313.
- Wang RL, Bencic D, Villeneuve DL, et al. A transcriptome-based biological framework for studying mechanisms of endocrine disruption in small fish species. Aquat Toxicol. 2010;98(3):230-244. doi: 10.1016/j.aquatox.2010.02.021.
- Roques BB, Leghait J, Lacroix MZ, et al. The nuclear receptors pregnane X receptor and constitutive androstane receptor contribute to the impact of fipronil on hepatic gene expression linked to thyroid hormone metabolism. Biochem Pharmacol. 2013;86(7):997-1039. doi: 10.1016/j.bcp.2013.08.012.
- Тыщенко В.П., Кинд Т.В. Нейроэндокринные механизмы регуляции сезонных циклов // Гормональная регуляция развития насекомых. — Л.: Наука, 1983. — Глава 5. — С. 82–117. [Tyshchenko VP, Kind TV. Neuroendocrine mechanisms of regulation of seasonal cycles. Leningrad: Nauka. Chapter 5, Hormonal regulation of insect development; 1983. P. 82-117.
- Kubrak OI, Kučerova I, Theopold U, Nässel DR. The sleeping beauty: how reproductive diapause affects hormone signaling, metabolism, immune response and somatic maintenance in drosophila melanogaster. PLoS One. 2014;9(11):e 113051. doi: 10.1371/journal. pone. 0113051.
- Kumar A, Congiu L, Lindström L, et al. Sequencing, De Novo assembly and annotation of the Colorado potato beetle, Leptinotarsa decemlineata, transcriptome. PLoS One. 2014;9(1): e86012. doi: 10.1371/journal. pone. 0086012.
- Xu WH, Lu YX, Denlinger DL. Cross-talk between the fat body and brain regulates insect developmental arrest. PNAS. 2012;109(36). doi: 10.1073/pnas.1212879109.
- Ehlen JC, Paul KN. Regulation of light’s action in the mammalian circadian clock: role of the extrasynaptic GABAA receptor. Am J Physiol Regul Integr Comp Physiol. 2009;296(5):1606-1612. doi: 10.1152/ajpregu.90878.2008.
- De Loof A. The essence of female-male physiological dimorphism: differential Ca2+-homeostasis enabled by the interplay between farnesol-like endogenous sesquiterpenoids and sex-steroids? The calcigender paradigm. Gen Comp Endocrinol. 2015;211:131-146. doi: 10.1016/j.ygcen.2014.12.003.
- Wei Q, Wu SF, Niu CD, et al. Knockdown of the ionotropic γ-aminobutyric acid receptor (GABAR) RDL gene decreases fipronil susceptibility of the small brown planthopper, Laodelphax striatellus(Hemiptera: Delphacidae). Arch Insect Biochem Physiol. 2015;88(4): 249-261. doi: 10.1002/arch.21232.
- Taylor-Wells J, Brooke BD, Bermudez I, Jones AK. The neonicotinoid imidacloprid and the pyrethroid deltamethrin are antagonists of the insect Rdl GABA receptor. J Neurochem. 2015;135(4):705-7013. doi: 10.1111/jnc.13290.
- Impagnatiello F, Pesold C, Longone P, et al. Modifications of gamma-aminobutyric acid A receptor subunit expression in rat neocortex during tolerance to diazepam. Mol Pharmacol. 1996;49(5):822-831. PMID: 8622632.
- Беньковская Г.В., Китаев К.А., Удалов М.Б. Успех переживания экспериментальной диапаузы и резистентность к инсектицидам в популяциях колорадского жука / Экология, эволюция и систематика животных: материалы международной научно-практической конференции. Ноябрь 13–16, 2012; Рязань, с. 45–46. [Benkovskaya GV, Udalov MB, Kitaev KA. The success of survival under experimental diapause and insecticide resistance in Colorado beetle populations in the South Urals. Ecologia, evoliyutsia I sistematika zhivotnyh [conference proceedings]. 2012 November 13-16. Ryazan. P. 45-46. (In Russ.)]
Дополнительные файлы











