Comparative evaluation of morphological criteria of endometrial dysfunction in patients with infertility associated with pelvic inflammatory disease, external genital endometriosis and uterine myoma
- Authors: Tolibova G.K.1
-
Affiliations:
- FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O.Ott”
- Issue: Vol 65, No 6 (2016)
- Pages: 52-60
- Section: Articles
- Submitted: 15.12.2016
- Published: 15.12.2016
- URL: https://journals.eco-vector.com/jowd/article/view/5880
- DOI: https://doi.org/10.17816/JOWD65652-60
- ID: 5880
Cite item
Full Text
Abstract
Background. The comparative evaluation of morphological criteria of endometrial dysfunction in patients with primary infertility associated with pelvic inflammatory disease, external genital endometriosis and uterine myoma revealed common morphological manifestations in the form of an imbalance of the endometrium receptor profile on the background of the high frequency of chronic endometritis.
The aim of the study was the comparative evaluation of ER and Pg receptors expression, inflammatory markers and an inhibitor of cyclin-dependent kinases p16ink4a in the endometrium of women with infertility associated with pelvic inflammatory disease, endometriosis and uterine myoma.
Materials and methods. The study was included 298 patients: 95 patients with infertility associated with pelvic inflammatory disease, 73 women with infertility associated with external genital endometriosis degree I-II, 70 patients with infertility associated with uterine myoma and 60 patients with infertility associated with male factor. All patients were examined and treated in FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott”. Endometrial biopsies were performed on 19-24 day of the cycle. Histological and immunohistochemical study of endometrial biopsies were performed by standard methods. The expression of ER and PgR receptors, inflammatory markers (CD8+, CD20+, CD4+, SD138+) and cyclin-dependent kinase inhibitor p16INK4a was studied by the immunohistochemical method. The evaluation of the markers expression was performed by semiquantitative method H-Score, as well as qualitative and quantitative methods of computer image analysis system “Morphology 5.0” (VideoTest, Russia). Statistical processing of the results was performed using statistical packages (STATGRAPHICS v.6.0).
Results. There is a violation of the endometrium secretory transformation in patients with infertility associated with pelvic inflammatory disease, uterine myoma and external genital endometriosis on the background of the high frequency of chronic endometritis. Receptor imbalance is characterized by impaired ER and PgR receptor ratio in the glands and in endometrial stromal component as a result of chronic inflammation.
Full Text
Введение
В современной гинекологии проблема бесплодия, ассоциированного с эндометриальной дисфункцией, приобретает актуальный характер в связи с высокой частотой встречаемости данной патологии. Эндометриальная дисфункция — обратимые или условно обратимые морфофункциональные изменения эндометрия, в основе которых лежат нарушения молекулярных механизмов, приводящие к нарушению имплантации, плацентации и гибели эмбриона [1].
Следует отметить, что работы, проведенные как отечественными, так и зарубежными исследователями, показали, что у пациенток с бесплодием, ассоциированным с воспалительными заболеваниями органов малого таза (ВЗОМТ), наружным генитальным эндометриозом (НГЭ) и миомой матки, отмечается высокая частота хронического воспалительного процесса в эндометрии [2–9, 11].
Воспалительные заболевания органов малого таза прочно занимают лидирующую позицию среди гинекологических заболеваний в целом. Особую озабоченность вызывает тот факт, что в последнее десятилетие частота ВЗОМТ выросла в 1,5 раза, что крайне неблагоприятно сказывается на реализации репродуктивной функции. Высокая частота встречаемости бесплодия среди пациенток с наружным генитальным эндометриозом также представляет актуальную проблему современной гинекологии. Данное заболевание диагностируется у 6–50 % женщин репродуктивного возраста с пиком верификации в 30–39 лет [6, 9, 10, 12–14]. Миома матки выявляется у 30–35 % пациенток репродуктивного возраста и также может приводить к нарушению фертильности [8, 15].
Этиопатогенетические аспекты ВЗОМТ изучены достаточно подробно многими авторами, тогда как этиологические факторы развития НГЭ и миомы матки так и остаются до конца не выясненными. К настоящему времени имеются данные о том, что у больных с НГЭ имеет место нарушение секреторной трансформации эутопического эндометрия и изменение его чувствительности к половым стероидным гормонам, при этом дискуссии по поводу роли миомы матки в нарушении рецептивности эндометрия продолжаются [12, 13, 15].
Если у пациенток с вторичным бесплодием, невынашиванием беременности, неэффективными попытками ЭКО на фоне высокой частоты хронического эндометрита отмечается нарушение секреторной трансформации эндометрия, то открытым остается вопрос о морфофункциональном состоянии эндометрия у пациенток с первичным бесплодием, ассоциированным с НГЭ I, II степеней и малыми формами субсерозных и интрамуральных миом матки.
Клинические аспекты вышеперечисленных патологических состояний подробно изучены, однако данные об иммуногистохимическом исследовании экспрессии рецепторов ER и PgR, а также провоспалительных маркеров в зависимости от нозологической формы фрагментарны, что, в свою очередь, значительно осложняет выбор тактики обследования и лечения пациенток данных групп.
Детальное изучение морфологических аспектов экспрессии рецепторов половых стероидных гормонов и маркеров воспаления в эндометрии у пациенток с бесплодием, а также выяснение их роли в патогенезе эндометриальной дисфункции, остается одной из основных научно-практических проблем современной репродуктологии.
Материалы и методы
В исследование были включены 298 пациенток, проходивших обследование и лечение на базе ФГБНУ «НИИ АГиР им. Д.О. Отта». Были сформированы 4 группы из пациенток с первичным бесплодием. В I группу вошли 95 пациенток с бесплодием, ассоциированным с воспалительными заболеваниями органов малого таза, II группа — 73 пациентки с бесплодием, ассоциированным c наружным генитальным эндометриозом I–II степени, III группа — 70 пациенток с бесплодием, ассоциированным с миомой матки (субсерозная и интрамуральная формы с диаметром узлов не более 2,5 см), IV группа (сравнения) была сформирована из 60 пациенток с бесплодием, ассоциированным с мужским фактором.
Общие критерии включения в основные группы: возраст от 18 до 40 лет, отсутствие гормонального лечения за 6 месяцев до настоящего исследования, а также индивидуальные по группам: в I группе — пациентки с первичным бесплодием, ассоциированным с ВЗОМТ, во II группе — пациентки с первичным бесплодием, ассоциированным c наружным генитальным эндометриозом I–II степени (R-AFS), подтвержденным при лапароскопии, в III группе — пациентки с бесплодием, ассоциированным с миомой матки, подтвержденной при лапароскопии.
Критериями включения в группу сравнения являлись: возраст 19–35 лет; отсутствие признаков воспалительных заболеваний органов малого таза, генитального эндометриоза, миомы матки при эндоскопическом обследовании; отсутствие гормонального лечения в течение 6 месяцев, предшествующих настоящему исследованию; наличие ранней и средней фазы секреции при гистологическом исследовании биоптата эндометрия на 19–24-й день менструального цикла; отсутствие гистологических признаков хронического эндометрита; наступление беременности, закончившейся срочными родами в течение одного года после включения в исследование.
Критерии исключения из исследования: сахарный диабет, ожирение, гипергонадотропная и гипогонадотропная недостаточность яичников, синдром поликистозных яичников, атипическая железистая гиперплазия эндометрия, аномалии развития полового аппарата; уровень антимюллерова гормона менее 0,5 нг/мл, критические нарушения сперматогенеза: иммунологическое бесплодие — MAR-test ≥ 50 % (по ВОЗ, 2010).
Всем обследуемым пациенткам проводился комплекс стандартных клинических и лабораторных исследований. Биопсия эндометрия осуществлялась всем пациенткам на 19–24-й день менструального цикла. Гистологическое исследование эндометрия проводили по стандартной методике. Для обзорной окраски использовали гематоксилин и эозин. При световой микроскопии оценивали соответствие эндометрия дню менструального цикла, состояние желез, стромы и сосудистого компонента эндометрия, а также наличие или отсутствие гистологических признаков воспалительных и патологических изменений.
Иммуногистохимический метод исследования включал: количественную и качественную оценку экспрессии рецепторов эстрогена (ER), прогестерона (PgR) в биоптатах эндометрия с использованием антител к рецепторам ER α (альфа) (клон 1D5) и рецепторам PgR (клон PgR636) в стандартном разведении 1 : 50 производства (Dako) Cytomation. Оценку проводили полуколичественным методом Histochemical Score = Σ P (i) × I, где i — интенсивность окрашивания, выраженная в баллах от 0 до 3; P (i) — процент клеток, окрашенных с разной интенсивностью. Максимальное значение гистосчета соответствовало 300. Для верификации хронического эндометрита использовали антитела СD8+ (клон СD8/144B); СD20+ (клон L26); СD4+ (клон 4В12) и СD138+ (клон М115) в стандартном разведении 1 : 50 (Dako) Cytomation. Критериями постановки диагноза хронического эндометрита являлись: увеличение количества цитотоксических T-лимфоцитов, В-лимфоцитов в 2 и более раза, наличие плазмоцитов. Для количественной и качественной оценки экспрессии ингибитора циклинзависимой киназы p16ink4a использовали набор CINtec p16ink4a Histology Kit (Roche, Germany). Качественную оценку экспрессии данного маркера подтвердили с помощью системы компьютерного анализа изображений «Морфология 5.0» (ВидеоТест, Россия). В ряде случаев проводили иммунофлюоресцентное исследование с применением конфокальной лазерной сканирующей микроскопии.
Для проведения иммуногистохимической иммунофлюоресцентной реакции использовали стандартный одноэтапный протокол. Методика для визуализации иммуногистохимической реакции выполнялась по схеме, предложенной С.В. Петровым и Н.Т. Райхлиным (2004). Статистическую обработку полученных результатов проводили с применением стандартных пакетов статистического анализа (STATGRAPHICS v.6.0).
Результаты исследования
Средний возраст пациенток в исследуемых группах был сопоставим и составил 31,6 ± 0,4, 30,5 ± 0,36, 31,7 ± 0,52 и 30,7 ± 0,5 года соответственно. Средний возраст наступления менархе не имел статистически значимых различий в группах и составил 13,1 ± 0,74; 13,6 ± 0,18; 12,4 ± 0,36 и 12,8 ± 0,58 года соответственно. Длительность менструального цикла в исследуемых группах составила от 28 до 35 дней. Длительность бесплодия у пациенток I группы составила 5,2 года, II группы — 5 лет и III группы — 6,5 года.
У пациенток с бесплодием, ассоциированным с ВЗОМТ, хронический сальпингоофарит был диагностирован у 44,2 % (42) пациенток, синехии полости матки диагностированы в двух случаях, гидросальпинкс — у 10,5 % (10) и цервициты — у 31,6 % (30) пациенток. Следует отметить, что на сегодняшний день полимикробная этиология ВЗОМТ не вызывает сомнений, но особого внимания заслуживают пациентки — носители вирусов папилломы человека и простого герпеса. Результаты проведенного нами исследования показали высокую встречаемость вируса простого герпеса 1-го и 2-го типов, вируса папилломы человека высокого онкогенного риска (16, 18, 31, 33-й типы) у пациенток с бесплодием, ассоциированным с ВЗОМТ и НГЭ (17,9 и 16,4 % соответственно) [5, 9]. В то же время у пациенток с бесплодием, ассоциированным с миомой матки, вирус простого герпеса 1-го и 2-го типов был выявлен у 40,0 % (28) пациенток, вирус папилломы человека высокого онкогенного риска (16, 18, 31, 33-й типы) — у 35,7 % (25) обследованных пациенток. Сочетание вирусов простого герпеса 1-го и 2-го типов, вируса папилломы человека и вируса Эпштейна – Барр отмечалось у 22,8 % (16) пациенток.
Гистологическое исследование биоптатов эндометрия показало, что ранняя стадия фазы секреции в I и II группах отмечалась у 15,8 и 20,5 % (по 15 в каждой группе) пациенток, в III группе — у 24,3 % (17) пациенток. Средняя стадия фазы секреции в I группе была диагностирована у 48,4 % (46), во II группе — у 42,5 % (31) и в III группе — у 42,8 % (30) пациенток. Нарушение структуры эндометрия, характеризующееся гиперплазией эндометрия и отставанием в развитии стромального компонента, наблюдалось у 38,9 % (37) пациенток с бесплодием, ассоциированным с ВЗОМТ, у 42,5 % (31) пациенток с НГЭ и у 48,6 % (34) пациенток с бесплодием, ассоциированным с миомой матки. Полип эндометрия диагностирован в каждом 10-м случае в I группе, у каждой 6-й пациентки с бесплодием, ассоциированным с миомой матки, и у каждой 5-й пациентки с НГЭ. В группе сравнения у 25,0 % (15) пациенток эндометрий соответствовал ранней стадии фазы секреции, у 75,0 % (45) — средней стадии фазы секреции.
Результаты комплексного гистологического и иммуногистохимического исследования биоптатов эндометрия выявили хронический эндометрит у 71,5 % (68) пациенток I группы, у 80,0 % (60) пациенток II группы исследования и 88,6 % (62) пациенток III группы. В структуре хронического эндометрита во всех группах преобладала умеренная степень выраженности воспалительного процесса с 3–4-кратным повышением цитотоксических Т-лимфоцитов (CD8+), В-лимфоцитов (CD20+) и наличием плазмоцитов (CD138+). В группе сравнения только у 5 % (3) пациенток отмечались признаки хронического эндометрита слабой степени выраженности. Данные исследования хронического эндометрита у пациенток основных групп представлены на рис. 1.

Рис. 1. Степень выраженности хронического эндометрита у пациенток в исследуемых группах
Fig. 1. The severity of chronic endometritis in patients in the study groups
В основных группах слабо выраженный хронический эндометрит был выявлен у 15,8, 21,3 и 18,5 % обследуемых пациенток. Выраженный хронический воспалительный процесс характеризовался 5-кратным и более повышением количества иммунопозитивных клеток. На рис. 2 представлена экспрессия провоспалительных маркеров в эндометрии пациенток основных групп.

Рис. 2. Конфокальная лазерная сканирующая микроскопия: a) диффузное расположение CD8+-позитивных клеток в стромальном компоненте эндометрия; b) очаговое расположение CD138+-позитивных клеток в эндометрии; c) положительная экспрессия p16ink4a в люминальном эпителии и стромальном компоненте эндометрия. Экспрессии CD8+, CD138+ — красное окрашивание. Экспрессия p16ink4a — оранжевое окрашивание. Ядерное окрашивание — Hoechst, ×100
Fig. 2. Confocal laser scanning microscopy. a) diffuse location of CD8+ positive cells in the stromal component of the endometrium. b) focal location of CD138+ positive cells in the endometrium. c) positive expression of p16ink4a in the luminal epithelium and endometrial stromal component. The expression of CD8+, CD138+ is showed in red staining. The expression of p16ink4a is showed in orange color. The nucleus of each cell are stained blue with Hoechst, ×100
Результаты иммуногистохимического исследования ингибитора циклинзависимой киназы p16ink4a в эндометрии выявили положительную экспрессию белка р16ink4a у 75,8 % (72) пациенток I группы, у 100 % (73) обследуемых II группы и у 87,1 % (61) пациенток III группы. Результаты исследования маркера в группе сравнения показали слабоположительную экспрессию белка p16ink4a в поверхностном эпителии эндометрия только у 5,0 % (3) пациенток.
При хроническом эндометрите основной проблемой является нарушение рецепторного профиля эндометрия, поскольку воспалительный процесс служит кофактором и приводит к снижению экспрессии рецепторов за счет фибропластических изменений в строме и сосудистом компоненте эндометрия и, как следствие, нарушению кровоснабжения ткани. На рис. 3 представлено снижение экспрессии рецепторов ER и PgR на фоне хронического эндометрита.
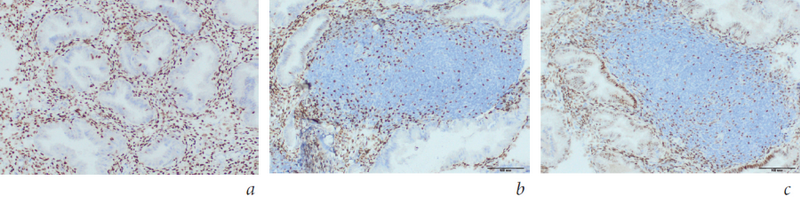
Рис. 3. Равномерное распределение экспрессии рецепторов PgR в стромальном компоненте эндометрия (a). ИГХ ×200; снижение экспрессии рецепторов ER и PgR в фолликулоподобных структурах стромального компонента эндометрия (b, c). ИГХ ×200
Fig. 3. a – The uniform distribution of PgR receptor expression in endometrial stromal component. IHC ×200. b, c – Reducing ER and PgR receptor expression in follicle-like structures of the stromal endometrium component. IHC ×200
Оценку экспрессии рецепторов ER и PgR, согласно установленным критериям, проводили в среднюю стадию фазы секреции, характеризующуюся максимальной концентрацией прогестерона в крови женщины. Секреторная трансформация стромы эндометрия в этот период достигает пика с равномерным распределением и максимальной экспрессией рецепторов прогестерона, столь необходимых для наступления и развития беременности. В табл. 1 представлена экспрессия рецепторов ER и PgR в исследуемых группах.
Таблица 1.Экспрессия рецепторов ER и PgR в железах и строме эндометрия в среднюю стадию фазы секреции
Table 1. The expression of ER and PgR receptors in endometrial glands and stroma at secondary stage of secretion phase
Маркер /H-score | I группа (n = 46) | II группа (n = 31) | III группа (n = 30) | IV группа (n = 30) |
ER в железах | 112,0 ± 7,4* | 94,2 ± 9,7* | 110,7 ± 8,1* | 135,3 ± 4,02 |
ER в строме | 81,9 ± 7,4** α | 97,0 ± 5,8** | 105,6 ± 7,9* | 149,3 ± 2,10 |
PgR в железах | 130,5 ± 8,4*** | 93,8 ± 14,8** β | 154,3 ± 10,5** | 43,0 ± 2,9 |
PgR в строме | 112,0 ± 7,4*** | 180,0 ± 7,5 ** | 194,8 ± 6,8** αα | 268,0 ± 2,23 |
Примечание: *p < 0,05, **p < 0,01, ***p < 0,001 по сравнению c IV группой; α p < 0,05, β p < 0,05 по сравнению с III группой; **p < 0,01 по сравнению со II группой; αα p < 0,01 по сравнению с I группой | ||||
Результаты исследования показали достоверное снижение экспрессии рецепторов ER в железах и стромальном компоненте в основных группах при сопоставлении с группой сравнения (*p < 0,05; **p < 0,01). Экспрессия рецепторов ER в стромальном компоненте эндометрия у пациенток I группы была достоверно ниже по сравнению с биоптатами эндометрия пациенток III группы (αp < 0,05). Сравнение экспрессии данного маркера между II и III группами не выявило статистически значимых отличий. В основных группах экспрессия рецепторов PgR в железах была достоверно выше при сопоставлении с группой сравнения в отличие от экспрессии данного маркера в строме эндометрия (**p < 0,01; ***p < 0,001). При сравнении экспрессии рецепторов PgR у пациенток основных групп отмечалось ее достоверное снижение в железах у пациенток с бесплодием, ассоциированным с НГЭ (βp < 0,05). На рис. 4 представлена экспрессия рецепторов PgR в биоптатах эндометрия у обследованных пациенток.

Рис. 4. Конфокальная лазерная сканирующая микроскопия: a) равномерное распределение экспрессии PgR в строме эндометрия, в железистом компоненте экспрессия снижена до 0; b, c) снижение экспрессии рецепторов PgR в строме. Экспрессия PgR — зеленое окрашивание. Ядерное окрашивание — Hoechst, ×100, ×200
Fig. 4. Confocal laser scanning microscopy. a) uniform distribution of PgR expression in the endometrial stroma. The expression in glandular component is reduced to 0. b, c) reduction of PgR receptors expression in stroma. The expression of PgR is showed in green color. The nuclears are stained with Hoechst, ×100, ×200
При оценке экспрессии рецепторов PgR в стромальном компоненте отмечалось ее достоверное снижение во всех основных группах при сопоставлении с группой сравнения (**p < 0,01;***p < 0,001). Следует отметить, что при сравнении между основными группами было выявлено достоверное снижение экспрессии рецепторов PgR у пациенток с бесплодием, ассоциированным с ВЗОМТ (αα p < 0,01).
Обсуждение
Воспалительные заболевания органов малого таза являются одной из ведущих причин нарушений репродуктивной функции у женщин, поскольку рецидивы и хронизация воспалительного процесса служат причиной органических изменений в органах репродуктивной системы. По мнению И.Н. Данусевич и др., при ВЗОМТ более чем в половине случаев выявить возбудителя не удается и этиология воспалительного процесса остается невыясненной. Причиной этого является персистенция возбудителя в ткани органа или выходящие на первый план вторичные изменения (фиброз стромы и сосудов, спаечный процесс), когда роль микробного или вирусного агента теряет свою актуальность [17].
Следует отметить, что использование современных молекулярных методов диагностики эндометриальной дисфункции позволяет под другим углом взглянуть на нарушение морфофункционального состояния эндометрия на фоне хронического эндометрита. В то же время нельзя не уделять должного внимания и локальному эстрогензависимому хроническому воспалению в патогенезе нарушения рецептивности эндометрия [12–14]. Эти данные подтверждаются результатами исследования с выявлением высокой частоты хронического эндометрита в обследованных группах и наибольшим снижением экспрессии рецепторов PgR в строме эндометрия у пациенток с ВЗОМТ на фоне формирования фолликулоподобных инфильтратов, фибропластических и ишемических процессов в строме эндометрия, обусловленных длительной персистенцией инфекционных агентов.
Сравнительная межгрупповая оценка провоспалительных маркеров показала, что во всех группах отмечалось преимущественное увеличение цитотоксических Т-лимфоцитов и наличие плазмоцитов, имеющих связь не только с эстрогензависимым воспалительным процессом, но и с инфекционным агентом.
Если этиопатогенетические аспекты бесплодия, ассоциированного с ВЗОМТ, подробно изучены, то дискуссия по поводу бесплодия, ассоциированного с малыми формами миомы матки и НГЭ, продолжается. В литературе активно обсуждается мультифакторная природа миомы матки и НГЭ, когда главные роли отводятся половым гормонам, иммунной системе и особенностям генома, оказывающим непосредственное или опосредованное влияние на течение заболевания [13, 15, 16].
Cледует отметить, что как при НГЭ, так и при миоме матки абсолютная и относительная гиперэстрогенемия приводит к гиперпластической трансформации эндометрия, которая, в свою очередь, может служить самостоятельным фактором бесплодия. Результаты сравнительной оценки показали, что гиперплазия эндометрия наблюдалась у 20,0 % (19) пациенток с бесплодием, ассоциированным ВЗОМТ, у 23,3 % (17) пациенток с НГЭ и у 28,6 % (20) пациенток с бесплодием, ассоциированным с миомой матки. Десинхронизация рецепторов эстрогена и прогестерона приводит к нарушению секреторной трансформации эндометрия и может явиться причиной бесплодия. В то же время результаты проведенного нами исследования показали высокую частоту встречаемости хронического эндометрита у пациенток исследуемых групп, и полученные данные согласуются с исследованиями других авторов [6, 7, 11, 18].
Немаловажным остается факт, что клинико-анамнестические данные пациенток обследованных групп показали высокую встречаемость вирусов простого герпеса и вируса папилломы человека (высокого онкогенного риска), что позволяет предположить высокую вероятность цитопатического действия данных вирусов на эндометрий и может служить объяснением малосимптомного течения воспалительного процесса.
В последнее десятилетие активно изучается роль вирусов, в частности вируса папилломы человека и группы герпесвирусов, в этиологии рака яичников, рака эндометрия и онкологической трансформации эндометриом [19–23].
Иммуногистохимическое исследование ингибитора циклинзависимой киназы p16ink4a выявило положительную экспрессию данного маркера в гистогенетических структурах эндометрия у пациенток обследованных групп (75,8, 100, 87,1 % соответственно), при этом в группе сравнения была выявлена только слабоположительная экспрессия белка p16ink4a в поверхностном эпителии эндометрия у 5,0 % (3) пациенток.
Роль вирусов в этиопатогенезе пролиферативных и гиперпластических заболеваний органов малого таза на сегодняшний день изучена недостаточно. Неоспоримым является тот факт, что вирус, встраиваясь в геном клетки, способен менять ее генетическую структуру и привести к неконтролируемому делению клетки и неопластической трансформации, что позволяет предполагать важную роль вируса папилломы человека и вирусов группы герпеса в этиопатогенезе пролиферативных и гиперпластических процессов в органах малого таза.
Таким образом, сравнительная оценка морфологических критериев эндометриальной дисфункции у пациенток с первичным бесплодием, ассоциированным с ВЗОМТ, НГЭ и миомой матки, выявила общность морфологических проявлений в виде дисбаланса рецепторного профиля эндометрия на фоне высокой частоты хронического эндометрита. При этом локальная воспалительная реакция в эндометрии, обусловленная в том числе вирусным поражением, может оказывать влияние на имплантационные свойства эндометрия и явиться одной из главных детерминант бесплодия.
About the authors
Gulrukhsor Kh Tolibova
FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O.Ott”
Author for correspondence.
Email: gulyatolibova@mail.ru
MD. PhD Department of Pathomorphology Russian Federation
References
- Толибова Г.Х., Траль Т.Г., Клещев М.А. Эндометриальная дисфункция: алгоритм клинико-морфологического исследования: учебное пособие для врачей. – СПб., 2016. [Tolibova GH, Tral’ TG, Kleshhev MA. Jendometrial’naja disfunkcija: algoritm kliniko-morfologicheskogo issledovanija: uchebnoe posobie dlja vrachej. Saint Petersburg; 2016. (In Russ.)]
- Cicinelli E, DeZiegler D, Nicoletti R, et al. Chronic endometritis: correlation among hysteroscopic, histologic, and bacteriologic findings in a prospective trial with 2190 consecutive office hysteroscopies. Fertil Steril. 2008;89(3):677-84. doi: 10.1016/j.fertnstert.2007.03.074.
- Гомболевская Н.А., Муравьева В.В., Марченко Л.А., Анкирская А.С. Современные возможности этиологической диагностики хронического эндометрита // Акушерство и гинекология. – 2012. – № 8–1. – С. 40–45. [Gombolevskaja NA, Murav’eva VV, Marchenko LA, Ankirskaja AS. Current capabilities of the etiological diagnosis of chronic endometritis. Akusherstvo i ginekologija. 2012; (8-1):40-5. (In Russ.)]
- Сухих Г.Т., Шуршалина А.В. Хронический эндометрит: руководство. – М.: ГЭОТАР-Медиа, 2013. [Suhih GT, Shurshalina AV. Hronicheskij jendometrit: rukovodstvo. Moscow: GJeOTAR-Media; 2013. (In Russ.)]
- Айламазян Э.К., Толибова Г.Х., Траль Т.Г., и др. Клинико-морфологические детерминанты бесплодия, ассоциированного с воспалительными заболеваниями органов малого таза // Журнал акушерства и женских болезней. – 2015. – T. 67. – № 6. – C. 17–25. [Ajlamazjan JeK, Tolibova GH, Tral’ TG, et al. Clinical and morphological determinants of infertility associated with inflammatory diseases of the pelvic organs. Z Akus Zen Bolezn. 2015;67(6):17-25. (In Russ.)]
- Khan K, Fujishita A, Kitajima M, et al. Intra-uterine microbial colonization and occurrence of endometritis in women with endometriosis. Hum Reprod. 2014;29(11):2446-56. doi: 10.1093/humrep/deu222.
- Johnston-MacAnanny EB, Hartnett J, Engmann LL, et al. Chronic endometritis is a frequent finding in women with recurrent implantation failure after in vitro fertilisation. Fertil Steril. 2010;2(93):437-41. doi: 10.1016/j.fertnstert.2008.12.131.
- Сидорова И.С., Шешукова Н.А., Закаблукова С.В. Патология эндометрия при наличии миомы матки // Гинекология. – 2000. – T. 8. – № 4. – C. 6–10. [Sidorova IS, Sheshukova NA, Zakablukova SV. Patologija jendometrija pri nalichii miomy matki. Ginekologija. 2000;8(4):6-10. (In Russ.)]
- Айламазян Э.К., Толибова Г.Х., Траль Т.Г. Особенности экспрессии рецепторов половых стероидных гормонов, провоспалительных маркеров и ингибитора циклин-зависимой киназы p16ink4a в эндометрии при наружном генитальном эндометриозе // Журнал акушерства и женских болезней. – 2016. – T. 65. – № 3. – C. 4–11. [Ajlamazjan JeK, Tolibova GH, Tral’ TG, et al. The features of the expression of sex steroids hormone receptors, pro-inflammatory markers and cyclin-dependent kinase inhibitor protein p16ink4a in endometrium at external genital endometriosis. Z Akus Zen Bolezn. 2016;65(3):4-11. (In Russ.)]. doi: 10.17816/JOWD6534-11.
- Адамян Л.В., Кулаков В.И. Эндометриозы: руководство для врачей. – М.: Медицина, 2006. [Adamjan LV, Kulakov VI. Jendometriozy: rukovodstvo dlja vrachej. Moscow: Medicina; 2006. (In Russ.)]
- Kitaya К, Yasuo Т. Immunohistochemistrical and clinicopathological characterization of chronic endometritis. Am J Reprod Immunol. 2011Nov;66(5):410-5. doi: 10.1111/j.1600-0897.2011.01051.x.
- Bulun SE. Endometriosis. N Engl J Med. 2009;3(360):268-79. doi: 10.1056/NEJMra0804690.
- Giudice LC, Evers JLH, Healy DL. Endometriosis: Science and Practice. Wiley-Blackwell; 2012.
- Ярмолинская М.И., Денисова В.М. Значение генитального эндометриоза в патогенезе бесплодия // Журнал акушерства и женских болезней. – 2013. – T. 62. – № 6. – C. 67–77. [Jarmolinskaja MI, Denisova VM. Importance of genital endometriosis in pathogenesis of infertility. Z Akus Zen Bolezn. 2013;62(6):67-77. (In Russ.)]
- Штох Е.А., Цхай В.Б. Миома матки. Современное представление о патогенезе и факторах риска // Сибирское медицинское обозрение. – 2015. – № 1. – C. 22–27. [Shtoh EA, Chaj VB. Mioma matki. Sovremennoe predstavlenie o patogeneze i faktorah riska. Sibirskoe medicinskoe obozrenie. 2015;(1):22-27. (In Russ.)]
- Christofolini DM, Vilarino FL, Mafra FA, et al. Combination of polymorphisms in luteinizing hormone β, estrogen receptor β and progesterone receptor and susceptibility to infertility and endometriosis. Eur J Obstet Gynecol Reprod Biol. 2011;158(2):260-4. doi: 10.1016/j.ejogrb.2011.06.028.
- Данусевич И.Н., Сутурина Л.В., Ильин В.П., и др. Клинические признаки и гормональные нарушения у женщин репродуктивного возраста с хроническими заболеваниями органов малого таза вирусной этиологии // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. – 2011. – Т. 81. – № 5. – C. 21–23. [Danusevich IN, Suturina LV, Il’in VP, et al. Klinicheskie priznaki i gormonal’nye narushenija u zhenshhin reproduktivnogo vozrasta s hronicheskimi zabolevanijami organov malogo taza virusnoj jetiologii. Bjulleten’ vostochno-sibirskogo nauchnogo centra sibirskogo otdelenija rossijskoj akademii medicinskih nauk. 2011;81(5):21-3. (In Russ.)]
- Takebayashi A, Kimura F, Kishi Y, et al. The association between endometriosis and chronic endometritis. PLoS One. 2014;9(2):e88354. doi: 10.1371/journal.pone.0088354.
- Kaufman RH, Bornstein J, Gordon AN, et al. Detection of human papillomavirus DNA in advanced epithelial ovarian carcinoma. Gynecol Oncol. 1987;27(3):340-9.
- Антонеева И.И. Экспрессия антигенов вирусов папилломы человека, простого герпеса и фенотип рецепторов эстрогенов и прогестерона в малигнизированных эпителиальных опухолях яичников: Автореф. дис. … канд. мед. наук. – СПб., 2003. [Antoneeva II. Jekspressija antigenov virusov papillomy cheloveka, prostogo gerpesa i fenotip receptorov jestrogenov i progesterona v malignizirovannyh jepitelial’nyh opuholjah jaichnikov. [dissertation] Saint Petersburg; 2003. (In Russ.)]
- Мухтарулина С.В. Вирусная и бактериальная инфекция при злокачественных эпителиальных опухолях яичников: Автореф. дис. … канд. мед. наук. – М., 2005. [Muhtarulina SV. Virusnaja i bakterial’naja infekcija pri zlokachestvennyh jepitelial’nyh opuholjah jaichnikov. [dissertation] Moscow; 2005. (In Russ.)]
- Должиков А.А., Быков П.М., Нагорный А.В., и др. Ингибитор циклинзависимых киназ белок p16ink4a в гладкомышечных опухолях матки: диагностическое значение и молекулярно-генетические основы изменений экспрессии // Вестник новых медицинских технологий. – 2012. – T. 19. – № 2. – C. 125–127. [Dolzhikov AA, Bykov PM, Nagornyj AV, et al. Ingibitor ciklinzavisimyh kinaz belok p16ink4a v gladkomyshechnyh opuholjah matki: diagnosticheskoe znachenie i molekuljarno-geneticheskie osnovy izmenenij jekspressii. Vestnik novyh medicinskih tehnologij. 2012;2(19);125-7. (In Russ.)]
- Verit FF, Yucel O. Endometriosis, leiomyoma and adenomyosis: the risk of gynecologic malignancy. Asian Pac J Cancer Prev. 2013;10(14):5589-97. doi: 10.7314/APJCP.2013.14.10.5589.
Supplementary files








