Морфофункциональные особенности последов у несовершеннолетних женщин
- Авторы: Михайлин Е.С.1, Толибова Г.Х.2, Траль Т.Г.2
-
Учреждения:
- ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова»
- ФГБНУ «НИИ акушерства, гинекологии и репродуктологии имени Д.О. Отта»
- Выпуск: Том 65, № 5 (2016)
- Страницы: 41-48
- Раздел: Статьи
- Статья получена: 15.09.2016
- Статья опубликована: 15.09.2016
- URL: https://journals.eco-vector.com/jowd/article/view/5808
- DOI: https://doi.org/10.17816/JOWD65541-48
- ID: 5808
Цитировать
Полный текст
Аннотация
Актуальность. Углубленное изучение состояния фетоплацентарного комплекса, особенностей его реакций в ответ на гипоксию на фоне незрелости организма несовершеннолетних может помочь выявить основные направления профилактики определенных осложнений беременности и родов у несовершеннолетних, в первую очередь плацентарной недостаточности, гестоза, гипоксии плода.
Цель исследования. Изучить особенности гистологического строения плацент и экспрессии маркеров HIF-1α и VEGF-А в плацентах несовершеннолетних женщин.
Материалы и методы. Гистологическим методом было исследовано 74 последа от несовершеннолетних пациенток. Группу сравнения составили 25 последов от здоровых женщин среднего репродуктивного возраста (20–30 лет). В иммуногистохимическое исследование были включены 35 плацент от несовершеннолетних пациенток, которые были разделены на группы в зависимости от возраста и наличия или отсутствия хронической плацентарной недостаточности. Для изучения состояния сосудистого русла виллезного дерева плацент использовали моноклональные антитела эндотелиального сосудистого фактора роста VEGF-А (Clone UG1; 1 : 50, Dako), для оценки гипоксии в плаценте использовали антитела к маркеру гипоксия-индуцибельный фактор HIF-1α (H1 alpha 67; 1 : 100, GRTP (Abcam).
Результаты. Выявлено, что плаценты несовершеннолетних женщин характеризуются достоверной гипертрофией (559,5 ± 10,5 и 478,7 ± 12,9 г), большей частотой хронической плацентарной недостаточности (33,8–4,0 %) и менее выраженными компенсаторно-приспособительными реакциями (86,5–100 %). Выявлено повышение экспрессии гипоксия-индуцибельного фактора (HIF-1α) и сосудистого эндотелиального фактора роста (VEGF-A) в плацентах несовершеннолетних женщин с хронической плацентарной недостаточностью (ХПН) по сравнению с плацентами без ХПН.
Заключение. ХПН на момент рождения ребенка, выявляемая чаще у несовершеннолетних пациенток, может иметь значение в нарушении адаптационно-приспособительных механизмов и снижении качества жизни детей в постнатальном периоде. Повышение экспрессии HIF-1α и VEGF-A в плацентах несовершеннолетних женщин с ХПН является отражением активации ангиогенеза в ответ на внутриутробную гипоксию плода в условиях ХПН.
Полный текст
Введение
Плацента — важнейший компонент фетоплацентарной системы [1, 2] и давний объект гистологического изучения. Многочисленные исследования указывают на нарушение функционирования фетоплацентарного комплекса как на ключевую причину большинства осложнений беременности и родов у несовершеннолетних [3, 4].
На протяжении всего периода гестации в плаценте с разной интенсивностью протекают два процесса: васкулогенез — образование сосудов из клеток — предшественников ангиобластов и ангиогенез — образование новых сосудов из уже существующих [5]. Васкулогенез включает в себя организацию кровеносных сосудов из прогениторных эндотелиальных клеток или ангиобластов и наблюдается исключительно во время эмбриогенеза [6]. Ангиогенез рассматривается как пролиферация эндотелиальных клеток из уже существующих сосудов, данный процесс не ограничивается эмбриональным периодом и наблюдается при воспалении, иммунных реакциях, неоплазии [7]. Каждый из этих путей формирования кровеносных сосудов занимает особое место в течение беременности [8].
Важнейшей целью васкуло- и ангиогенеза является адекватная доставка кислорода к тканям развивающегося зародыша. Трофобласт обладает своей системой детекции кислорода, которая в настоящий момент недостаточно изучена [9]. Однако идентифицированы некоторые сигнальные пути, которые предполагают участие АФК и транскрипционных факторов, таких как HIF — гипоксия-индуцибельный фактор [10]. Активация HIF приводит к его связыванию с ДНК, привлечению тканеспецифических кофакторов и трансактивации генов-мишеней, которые находятся под контролем уровня содержания кислорода: факторов роста (HIF-1 является ведущим активатором VEGF и PLGF), эритропоэтина и других сигнальных субстанций, вовлеченных в развитие гипоксического ответа [9, 11].
Среди всех ангиогенных факторов семейство сосудистых эндотелиальных факторов роста (VEGF) считается основным в новообразовании сосудов [12]. Белки, относящиеся к семейству VEGF, представляют собой гликопротеины, стимулирующие формирование новых кровеносных и лимфатических сосудов. Взаимодействие между VEGF и рецептором активирует остаток тирозина, находящегося в интрацитоплазматической части рецептора и запускает различные сигнальные каскады в эндотелиальных клетках, такие как пролиферация, миграция и увеличение сосудистой проницаемости [13]. Клетки трофобласта экспрессируют VEGF, обеспечивая дифференцировку, миграцию и пролиферацию клеток, формирование, рост и развитие сосудистой сети в период васкуло- и ангиогенеза.
Углубленное изучение состояния фетоплацентарного комплекса, особенностей его реакций в ответ на гипоксию на фоне незрелости организма несовершеннолетних может помочь выявить основные направления профилактики определенных осложнений беременности и родов у несовершеннолетних, в первую очередь плацентарной недостаточности, гестоза, гипоксии плода. В общедоступной литературе нам не удалось обнаружить работ, посвященных иммуногистохимическим исследованиям экспрессии маркера гипоксии HIF-1α или VEGF-А в плацентах несовершеннолетних женщин.
Фрагментарные данные литературы послужили основанием для настоящего исследования.
Целью данной работы было изучить особенности гистологического строения плацент и экспрессии маркеров HIF-1α и VEGF-А в плацентах несовершеннолетних женщин.
Материалы и методы исследования
Гистологическим методом было исследовано 74 последа от несовершеннолетних пациенток. Группу сравнения составили 25 последов от здоровых женщин среднего репродуктивного возраста (20–30 лет).
Плаценты исследовались по стандартизованной схеме [2], включающей макроскопический анализ, вырезку материала и гистологическое исследование. Проводилось взвешивание и осмотр плацент. При этом определялась форма, количество долек, тип развития сосудов, место прикрепления пуповины. Производилась вырезка материала: 6 кусочков плацентарной ткани (2 — из краевой, 2 — из парацентральной и 2 — из центральной зон), также отбиралась средняя часть пуповины и спираль из плодных оболочек.
После взятия материал фиксировался в 10 % растворе нейтрального забуференного формалина в течение 24 часов. В последующем образцы обезвоживали в спиртах возрастающей концентрации (70–95 %), помещали в ксилол и заливали в парафин с помощью автоматической станции Leica TP1020. Для гистологического исследования готовили парафиновые срезы толщиной 3–7 мкм. Для обзорной окраски использовали гематоксилин и эозин. При световой микроскопии с помощью микроскопа Olympus CX-31 (Япония) оценивалась плацента: строение виллезного дерева, компенсаторно-приспособительные реакции, состояние сосудистого русла и пластинок плаценты (базальная, хориальная), наличие или отсутствие воспалительных и дистрофических изменений в плаценте. Плодовые оболочки: соотношение анатомических составляющих (амниотический слой, трофобластический эпителий, децидуальная оболочка), наличие воспалительной реакции и дистрофических изменений. Пуповина: состояние Вартонова студня, количество и состояние сосудистого русла, наличие воспалительных изменений.
В иммуногистохимическое исследование были включены 35 плацент от несовершеннолетних пациенток, которые были разделены на три группы в зависимости от возраста: I группа (13–15 лет) — 8 плацент, II группа (16 лет) — 14 плацент, III группа (17 лет) — 16 плацент. В зависимости от наличия или отсутствия хронической плацентарной недостаточности (ХПН) несовершеннолетние пациентки также были разделены на две группы. Первую группу составили 11 плацент от несовершеннолетних пациенток с ХПН, вторую группу — 13 плацент от несовершеннолетних пациенток без ХПН по данным гистологического исследования.
Для изучения состояния сосудистого русла виллезного дерева плацент использовали моноклональные антитела эндотелиального сосудистого фактора роста VEGF-А (Clone UG1; 1 : 50, Dako), для оценки гипоксии в плаценте использовали антитела к маркеру гипоксия-индуцибельный фактор HIF-1α (H1 alpha 67; 1 : 100, GRTP (Abcam)).
Иммуногистохимическое исследование проводили на парафиновых срезах толщиной 5 мкм, помещенных на предметные стекла, покрытые пленкой из поли-L-лизина (Sigma). В качестве системы визуализации использовали набор Dako Cytomation LSAB2 System-HRP (Dako). Негативный контроль выполнен с применением блокирующей сыворотки (DAKO LSAB2 kit). Для проведения иммуногистохимической реакции использовали стандартный одноэтапный протокол с демаскировкой антигена (высокотемпературной обработкой ткани) в 0,01 М цитратном буфере (рН 7,6).
Методика для визуализации иммуногистохимической реакции выполнялась по стандартной схеме [14].
Для оценки результатов иммуногистохимического исследования проводили морфометрическое исследование с использованием системы компьютерного анализа микроскопических изображений, состоящей из микроскопа Olympus, цифровой камеры Olympus-BX46 и программного обеспечения СellSens Entry. В каждом случае анализировали 5 полей зрения при увеличении ×400 [15]. Из фотосъемки исключались поля зрения, содержащие дефекты ткани, дефекты окрашивания и артефакты. Дальнейшее количественное исследование проводили с помощью программы компьютерного анализа изображений Морфология 5.0 (ВидеоТест, Россия). При наличии положительной реакции на антитела было измерено два параметра: оптическая плотность и площадь экспрессии. Оптическая плотность выражалась в у. е.
Площадь экспрессии рассчитывали как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах для маркеров с цитоплазматическим окрашиванием и как отношение площади, занимаемой иммунопозитивными ядрами к общей площади ядер в поле зрения для маркеров с ядерной экспрессией.
Статистический анализ полученных данных проводился с использованием программы STATISTICA 6.1 (Statsoft Inc., Tulsa, США). Определение достоверности различий между сравниваемыми группами по частотам проводили с помощью критерия Фишера (F) или хи-квадрат (χ2) по стандартной формуле. Для оценки различий значений клинических параметров между различными группами применялся U-критерий Манна – Уитни или t-критерий Стьюдента для независимых выборок. Регрессионный статистический анализ проводился с использованием коэффициента Пирсона для оценки линейной корреляции и коэффициентов Кендалла и Спирмена для учета возможной нелинейности взаимосвязи. Значение p < 0,05 принималось как статистически значимое, значение p < 0,1 расценивалось как тенденция.
Результаты исследования
Основные клинико-морфологические характеристики фетоплацентарной системы несовершеннолетних беременных женщин и женщин среднего репродуктивного возраста представлены в таблице 1.
Таблица 1. Основные клинико-морфологические характеристики фетоплацентарной системы несовершеннолетних беременных женщин и женщин среднего репродуктивного возраста
Table 1. The main clinical and morphological characteristics of the feto-placental system in minor pregnant women and women of average age
Клинико-морфологические | Несовершеннолетние | Женщины среднего репродуктивного возраста |
Возраст, лет | 16,3 ± 0,2* | 26,3 ± 0,7 |
Срок родов, нед. | 39,2 ± 0,2 | 39,4 ± 0,2 |
Масса новорожденных, г | 3391,8 ± 53,9 | 3492,4 ± 42,5 |
Длина новорожденных, см | 51,3 ± 0,3 | 51,7 ± 0,3 |
Оценка по шкале Апгар | 7–8 | 7–8 |
Масса последа, г | 559,5 ± 10,5* | 478,7 ± 12,9 |
Плацентарно-плодовый коэффициент | 0,17 ± 0,003* | 0,14 ± 0,003 |
Примечание. * p < 0,001 при сопоставлении между группами | ||
Следует отметить, что масса плацент в группе несовершеннолетних составила 559,5 ± 10,5 г, что было достоверно больше, чем масса в группе женщин среднего репродуктивного возраста (478,7 ± 12,9) (p < 0,001). Плацентарно-плодовый коэффициент в группе несовершеннолетних составил 0,17 ± 0,003, что было достоверно больше, чем плацентарно-плодовый коэффициент в группе женщин среднего репродуктивного возраста (0,14 ± 0,003) (p < 0,001).
В таблице 2 представлены основные гистологические характеристики последов несовершеннолетних беременных женщин и женщин среднего репродуктивного возраста.
Таблица 2. Основные гистологические характеристики последов несовершеннолетних беременных женщин и женщин среднего репродуктивного возраста
Table 2. The main histological characteristics of placentas in minor pregnant women and women of average age
Гистологические | Несовершеннолетние (n = 74) | Женщины среднего репродуктивного возраста (n = 25) |
Терминальный тип развития виллезного дерева (плацента соответствует сроку гестации) | 49 (66,2 %)* | 23 (93,0 %) |
Степень циркуляторных нарушений: • слабая; • умеренная; • выраженная; | 14 (19,0 %) 30 (40,5 %) 30 (40,5 %)* | 4 (16,0 %) 18 (72,0 %) 3 (12,0 %) |
Компенсаторно-приспособительные изменения (умеренно выраженные) | 64 (86,5 %)* | 25 (100 %) |
Хроническая плацентарная недостаточность: • диссоциированная форма; • гиперпластическая форма | 25 (33,8 %)* 21 (28,4 %) 4 (5,4 %) | 1 (4,0 %) 1 (4,0 %) 0 |
Воспалительные изменения: • экссудативный характер воспаления: • 1-я стадия (мембранозная); • 2-я стадия (поражение оболочек и плаценты); • 3-я стадия (пуповинная); • продуктивный характер воспаления | 26 (35,1 %)* 19 (25,7 %) 6 (8,1 %) 7 (9,5 %) 6 (8,1 %) 7 (9,5 %) | 0 |
Примечание. * p < 0,05 при сопоставлении между группами | ||
В группе несовершеннолетних строение плаценты соответствовало сроку гестации в 49 (66,2 %) случаях, что было достоверно меньше, чем в группе женщин среднего репродуктивного возраста (23 (93,0 %)) (p < 0,05). Следует отметить достоверную разницу (p < 0,05) в частоте встречаемости выраженной степени циркуляторных нарушений между группами: 30 (40,5 %) случаев в группе несовершеннолетних и только 3 (12,0 %) случая в группе женщин среднего репродуктивного возраста (в этой группе все случаи выраженных циркуляторных нарушений в плаценте были обусловлены кесаревым сечением). Компенсаторно-приспособительные изменения в плацентах несовершеннолетних пациенток встречались достоверно реже в (64 случая, 86,5 %, p < 0,05), чем в плацентах женщин среднего репродуктивного возраста (25 (100 %) случаев), и были умеренно выражены. Во всех плацентах изменения характеризовались небольшим количеством синцитиальных узелков, сохранением просвета интервиллезного пространства с умеренным кровенаполнением, отсутствием ишемических и геморрагических инфарктов.
Диссоциированная форма ХПН была диагностирована в 21 (28,4 %) случае и характеризовалась нарушением созревания виллезного дерева с персистенцией промежуточных зрелых ворсин хориона и уменьшением числа ворсин терминального типа (рис. 1). В 4 (5,4 %) случаях был выявлен гиперпластический тип хронической плацентарной недостаточности, характеризующийся обилием мелких терминальных ворсин в плаценте (рис. 2).
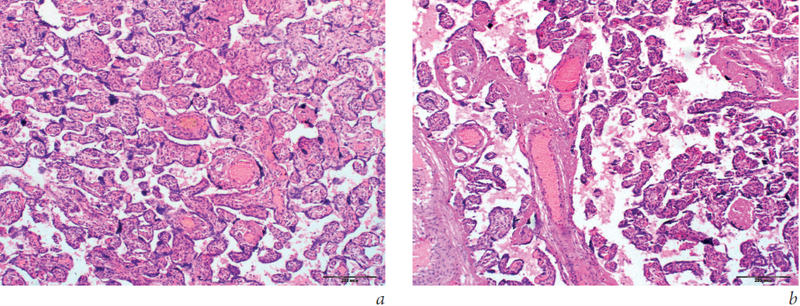
Рис. 1. Хроническая плацентарная недостаточность, субкомпенсированная стадия: a — преимущественно промежуточный тип развития виллезного дерева с неравномерным кровенаполнением сосудистого русла ворсин, полнокровием вен промежуточных ворсин и относительным малокровием терминальных ворсин хориона; b — дилатация, полнокровие вен и спазм артерий стволовых ворсин, относительное малокровие терминальных ворсин хориона. Г-Э, ×100
Fig. 1. Chronic placental insufficiency, subcompensated stage: a — Advantageously intermediate type of villous tree with uneven development of hyperemia of vascular in villi, congestion of veins in intermediate villi and a relative anemia in terminal chorionic villi; b — Dilation, congestion of veins and arteries spasm in stem villi, the relative anemia in terminal chorionic villi. G-E, ×100
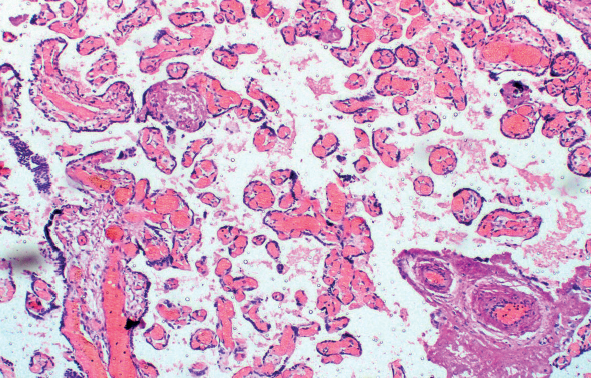
Рис. 2. Хроническая плацентарная недостаточность, гиперпластическая форма. Гиперваскуляризация и полнокровие сосудистого русла промежуточных и терминальных ворсин хориона с диапедезом эритроцитов в строму ворсин. Г-Э, ×100
Fig. 2. Chronic placental insufficiency, hyperplastic form.
Hypervascularisation and vascular congestion in intermediate and terminal chorionic villi with the diapedesis of red blood cells in the stroma of villi. G-E, ×100
Воспалительные изменения в последах группы несовершеннолетних были выявлены в 26 (35,1 %) случаях и носили экссудативный (19 (25,7 %) случаев) и продуктивный (7 (9,5 %) случаев) характер, при этом воспалительных изменений в последах женщин среднего репродуктивного возраста выявлено не было (p < 0,05). Частота выявления экссудативного воспалительного процесса с вовлечением только плодных оболочек (бактериальное инфицирование 1-й стадии, мембранозной) и всех составляющих последа (бактериальное инфицирование 3-й стадии, пуповинной) составила 6 (8,1 %) случаев для мембранозной стадии и 7 (9,5 %) случаев для пуповинной. В структуре экссудативного воспалительного процесса преобладало поражение плодных оболочек (париетальный хориодецидуит и мембранит) и плаценты (субхориальный интервиллузит, плацентарный хориоамнионит) в 10 (13,5 %) случаях, в то время как воспалительные изменения в пуповине (флебофуникулит и сосудисто-стромальный фуникулит) присутствовали в 7 (9,5 %) случаях. Гематогенная инфекция в последах была диагностирована в 7 (9,5 %) случаях и проявлялась развитием диссеминированного продуктивного виллузита в 3 (11,5 %) случаях и продуктивного децидуита с париетальной и базальной локализацией в 4 (15,4 %) случаях от общего числа воспалительных изменений в последах несовершеннолетних.
Результаты иммуногистохимического исследования плацент от несовершеннолетних женщин в зависимости от возраста представлены в таблице 3.
Таблица 3. Экспрессия гипоксия-индуцибельного фактора-1 (HIF-1α) в плацентах в зависимости от возраста женщин
Table 3. Expression of hypoxia-inducible factor-1 (HIF-1α) in placentas depending on the age of women
Возраст | Площадь экспрессии, % | Оптическая плотность, у. ед. |
13–15 лет (n = 8) | 8,5 ± 1,5 | 0,10 ± 0,01 |
16 лет (n = 14) | 11,2 ± 2,4 | 0,09 ± 0,006 |
17 лет (n = 16) | 7,8 ± 0,7 | 0,10 ± 0,009 |
Как видно из таблицы 3, межгрупповое сравнение площади экспрессии и оптической плотности экспрессии HIF-1α не выявило статистически значимых отличий. Для последующего анализа иммуногистохимического исследования экспрессии HIF-1α были выделены группы с гистологически установленной ХПН, данные представлены в таблице 4.
Таблица 4. Экспрессия гипоксия-индуцибельного фактора-1 (HIF-1α) в плацентах в зависимости от наличия хронической плацентарной недостаточности
Table 4. Expression of hypoxia-inducible factor -1 (HIF-1α) in placentas depending on the availability of chronic placental insufficiency
Группа | Площадь экспрессии, % | Оптическая плотность, у. ед. |
С хронической плацентарной недостаточностью (n = 11) | 11,4 ± 2,9 | 0,10 ± 0,003 |
Без хронической плацентарной недостаточности (n = 13) | 8,2 ± 0,93 | 0,08 ± 0,0001 |
При сравнении внутри групп отмечалась тенденция к повышению площади экспрессии и оптической плотности HIF-1α в плацентах с ХПН.
В таблице 5 представлена экспрессия сосудистого эндотелиального фактора роста (VEGF-A) в плацентах в зависимости от возраста женщин.
Таблица 5. Экспрессия сосудистого эндотелиального фактора роста – A (VEGF-A) в плацентах в зависимости от возраста женщин
Table 5. Expression of vascular endothelial growth factor (VEGF-A) in placentas depending on the age of women
Возраст | Площадь экспрессии, % | Оптическая плотность, у. ед. |
13–15 лет (n = 8) | 16,8 ± 0,99 | 0,12 ± 0,006 |
16 лет (n = 14) | 15,3 ± 1,3 | 0,12 ± 0,004 |
17 лет (n = 16) | 17,7 ± 0,7 | 0,12 ± 0,004 |
Как видно из представленных данных, при межгрупповой оценке площади экспресии и оптической плотности маркера VEGF-A значимых отличий не отмечалось.
Сравнительная оценка экспрессии данного маркера в плацентах в зависимости от наличия или отсутствия ХПН представлена в таблице 6.
Таблица 6. Экспрессия сосудисто-эндотелиального фактора роста – A (VEGF-A) в плацентах зависимости от наличия хронической плацентарной недостаточности
Table 6. Expression of vascular endothelial growth factor – A (VEGF-A) in placentas depending on the availability of chronic placental insufficiency
Группа | Площадь экспрессии, % | Оптическая плотность, у. ед. |
С хронической плацентарной недостаточностью (n = 11) | 17,6 ± 0,004 | 0,13 ± 0,004 |
Без хронической плацентарной недостаточности (n = 13) | 15,3 ± 1,3 | 0,12 ± 0,004 |
При сравнении внутри групп отмечалась тенденция к повышению площади экспрессии и оптической плотности VEGF-A в плацентах с ХПН.
По результатам корреляционного анализа с использованием коэффициента линейной корреляции Пирсона не было выявлено значимой взаимосвязи между возрастом, площадью экспрессии и оптической плотностью маркеров HIF-1α и VEGF-A (p > 0,05). Также не было выявлено значимой линейной взаимосвязи между площадью экспрессии одного и другого маркера, а также оптической плотностью обоих маркеров (p > 0,05).
Однако в соответствии с коэффициентами корреляции Кендалла и Спирмена наблюдается статистически значимая слабоотрицательная взаимосвязь между площадью экспрессии и оптической плотностью маркера HIF-1α (коэффициент Кендалла — – 0,230, коэффициент Спирмена — – 0,348, в обоих случаях p < 0,05).
Заключение
Гистологическое исследование последов несовершеннолетних женщин и женщин среднего репродуктивного возраста не выявило достоверных различий между группами в массо-ростовых показателях детей и их оценке по шкале Апгар. Однако результаты исследования показали, что гистологическое строение плацент у несовершеннолетних беременных женщин, по сравнению с женщинами среднего репродуктивного возраста, характеризуется достоверной гипертрофией и большей частотой ХПН с выраженной степенью циркуляторных нарушений. В плаценте несовершеннолетних женщин степень компенсаторно-приспособительных реакций была ниже и достоверно чаще выявлялись воспалительные изменения.
ХПН на момент рождения ребенка, выявляемая чаще у несовершеннолетних пациенток, может иметь значение в нарушении адаптационно-приспособительных механизмов и качестве жизни детей в постнатальном периоде. Следует также отметить, что масса плаценты и плацентарно-плодовый коэффициент в группе несовершеннолетних женщин по сравнению с женщинами среднего репродуктивного возраста были достоверно выше, что может указывать на неблагоприятные условия внутриутробного развития плода и плодово-плацентарных взаимоотношений у несовершеннолетних беременных женщин.
Проведенное иммуногистохимическое исследование выявило повышение экспрессии гипоксия-индуцибельного фактора (HIF-1α) и сосудисто-эндотелиального фактора роста — A (VEGF-A) в плацентах несовершеннолетних женщин с хронической плацентарной недостаточностью по сравнению с плацентами несовершеннолетних женщин без таковой. Изучаемые факторы служат отражением активации ангиогенеза в ответ на внутриутробную гипоксию плода в условиях хронической плацентарной недостаточности.
Авторы заявляют об отсутствии конфликтов интересов.
Об авторах
Евгений Сергеевич Михайлин
ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова»
Автор, ответственный за переписку.
Email: mihailin@mail.ru
ассистент кафедры акушерства и гинекологии Россия
Гулрухсор Хайбуллоевна Толибова
ФГБНУ «НИИ акушерства, гинекологии и репродуктологии имени Д.О. Отта»
Email: mihailin@mail.ru
канд. мед. наук, старший научный сотрудник лаборатории клеточной биологии отдела патоморфологии Россия
Татьяна Георгиевна Траль
ФГБНУ «НИИ акушерства, гинекологии и репродуктологии имени Д.О. Отта»
Email: mihailin@mail.ru
канд. мед. наук, заведующая патологоанатомическим отделением отдела патоморфологии Россия
Список литературы
- Гармашева Н.Л., Константинова H.H. Патофизиологические основы охраны внутриутробного развития человека. — Л.: Медицина, 1985. — 159 с. [Garmasheva NL, Konstantinova NN. Patofiziologiches¬kie osnovy okhrany vnutriutrobnogo razvitiya cheloveka. Leningrad: Meditsina; 1985. (In Russ.)]
- Милованов А.П. Патология системы мать — плацента — плод: руководство для врачей. — М., 1999. — 448 с. [Milovanov AP. Patologiya sistemy mat’ — platsenta — plod: rukovodstvo dlya vrachey. Moscow; 1999. (In Russ.)]
- Гуркин Ю.А., Суслопаров Л.А., Островская Е.А. Основы ювенильного акушерства. — СПб.: Фолиант, 2001. [Gurkin YuA, Susloparov LA, Ostrovskaya EA. Osnovy yuvenil’nogo akusherstva. Saint Petersburg: Foliant; 2001. (In Russ.)]
- Кротин П.Н. Научное обоснование службы охраны репродуктивного здоровья девушек-подростков: автореф. дис. д-ра мед. наук. — СПб., 1998. — 39 c. [Krotin PN. Nauchnoe obosnovanie sluzhby okhrany reproduktivnogo zdorov’ya devushek-podrostkov. [dissertation]. Saint Petersburg; 1998. (In Russ.)]
- Иванов Д.О., Петренко Ю.В., Кашменская В.Н. Особенности ангиогенеза у новорожденных с ЗВУР // Детская медицина Северо-Запада. — 2013. — Т. 4. — № 4. — С. 4–10. [Ivanov DO, Petrenko YuV, Kashmenskaya VN. Features angiogenesis in newborns with IUGR. Detskaya meditsina Severo-Zapada. 2013;4 (4):4-10. (In Russ.)]
- Pardanaud L, Yassine F, Dieterlen-Lievre F. Relationship between vasculogenesis, angiogenesis and haemopoiesis during avian ontogeny. Development. 1989;105(3):473-485.
- Urbich C, Dimmler S. Endotelial progenitor cells: characterization and role in vascular biology. Circ Res. 2004;95:343-353. doi: 10.1161/01.RES.0000137877.89448.78.
- Polin R, Fox W, Abman S. Fetal and Neonatal Physiology: Expert Consult (2-Volume Set). Philadelphia: Elsiver; 2011.
- Caniggia I, Winter J. Hypoxia inducible factor-1: oxygen regulation of trophoblast differentiation in normal and pre-eclamptic pregnancies. Placenta. 2002; 23:47-57. doi: 10.1053/plac.2002.0815.
- DeMarco CS, Caniggia I. Mechanisms of oxygen sensing in human trophoblasts. Placenta. 2002;23:58-68. doi: 10.1053/plac.2002.0809.
- Соснина А.К., Траль Т.Г., Крылова Ю.С. Функциональная морфология виллезного дерева плацент при доношенной одноплодной беременности, достигнутой методами вспомогательных репродуктивных технологий // Журнал акушерства и женских болезней. — 2016. — Т. LXV. — Вып. 3. — С. 49–57. [Sosnina AK, Tral’ TG, Krylova YuS. Functional morphology of the placentas villous tree at term singleton pregnancies achieved by methods of assisted reproductive technology. Journal of Obstetrics and Women´s Diseases. 2016;65(3):49-57. (In Russ.)]. doi: 10.17816/JOWD65349-57.
- Ferrara N. VEGF-A: a critical regulator of blood vessel growth. Eur Cytokine Netw. 2009;20(4):158-63. doi: 10.1684/ecn.2009.0170.
- Guo S, Colbert LS, Fuller M, et al. Vascular endothelial growth factor receptor-2 in breast factor. Biochim Biophys Acta. 2010;1806(1):108-121. doi: 10.1016/j.bbcan.2010.04.004.
- Петров С.В., Райхлин Н.Т. Руководство по иммуногистохимической диагностике опухолей человека. — Казань: Титул, 2004. — 452 с. [Petrov SV, Raykhlin NT. Rukovodstvo po immunogistokhimicheskoy diagnostike opukholey cheloveka. Kazan’: Tytul; 2004. (In Russ.)]
- Автандилов Г.Г. Медицинская морфометрия. Руководство. — М.: Медицина, 1990. — 384 с. [Avtandilov GG. Meditsinskaya morfometriya. Rukovodstvo. Moscow: Meditsina; 1990. (In Russ.)]
Дополнительные файлы








