Morfological and functional features of placentas in minor women
- Authors: Mikhaylin E.S1, Tolibova G.K2, Tral T.G2
-
Affiliations:
- North-Western State Medical University named after I.I. Mechnikov
- FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott”
- Issue: Vol 65, No 5 (2016)
- Pages: 41-48
- Section: Articles
- Submitted: 15.09.2016
- Published: 15.09.2016
- URL: https://journals.eco-vector.com/jowd/article/view/5808
- DOI: https://doi.org/10.17816/JOWD65541-48
- ID: 5808
Cite item
Full Text
Abstract
Relevance. An in-depth study of the state of feto-placental complex, the characteristics of its reactions in response to hypoxia on the background of juvenile immaturity of minors can help to identify the main directions of the prevention of certain complications of pregnancy and childbirth among minors in the first place — placental insufficiency, preeclampsia, fetal hypoxia. Purpose of the study was to explore features of the histological structure of placentas and expression of HIF-1α and VEGF-A markers in placentas in minors.
Materials and methods. 74 placentas from minors were investigated by histological methods. The comparison group consisted of 25 placentas from healthy women the average reproductive age (20-30 years). The immunohistochemical study was performed in 35 placentas from minors who were divided into groups according to age and the presence or absence of chronic placental insufficiency. To study vascular status of villous tree of placentas were used the monoclonal antibodies of the vascular endothelial growth factor VEGF-A (Clone UG1; 1 : 50, Dako), to assess hypoxia in placenta were used the monoclonal antibodies of hypoxia — inducible factor HIF-1α (H1 alpha 67; 1 : 100, GRTP (Abcam).
Results. It was revealed that the placenta in minors is characterized by hypertrophy (559,5 ± 10,5 g vs. 478,7 ± 12,9 g), it is pathologically immature (33,8% vs. 7,0%), there is significantly greater frequency of chronic placental insufficiency in minors (33,8% versus 4,0%) with significantly lower severity of compensatory-adaptive reactions (86,5% vs. 100%). It is shown increased expression of hypoxia — inducible factor (HIF-1) and vascular endothelial growth factor-A (VEGF-A) in placentas of minor women with chronic placental insufficiency, compared with placentas of minor women without chronic placental insufficiency.
Conclusion. Chronic placental insufficiency at the time of birth, detectable more frequently in minor patients can make a difference in violation of adaptive mechanisms and quality of life of children in the postnatal period. Increased expression of HIF-1α and VEGF-A in the placentas of minor women with chronic placental insufficiency reflects activation of angiogenesis in response to intrauterine fetal hypoxia in chronic placental insufficiency.
Full Text
Введение
Плацента — важнейший компонент фетоплацентарной системы [1, 2] и давний объект гистологического изучения. Многочисленные исследования указывают на нарушение функционирования фетоплацентарного комплекса как на ключевую причину большинства осложнений беременности и родов у несовершеннолетних [3, 4].
На протяжении всего периода гестации в плаценте с разной интенсивностью протекают два процесса: васкулогенез — образование сосудов из клеток — предшественников ангиобластов и ангиогенез — образование новых сосудов из уже существующих [5]. Васкулогенез включает в себя организацию кровеносных сосудов из прогениторных эндотелиальных клеток или ангиобластов и наблюдается исключительно во время эмбриогенеза [6]. Ангиогенез рассматривается как пролиферация эндотелиальных клеток из уже существующих сосудов, данный процесс не ограничивается эмбриональным периодом и наблюдается при воспалении, иммунных реакциях, неоплазии [7]. Каждый из этих путей формирования кровеносных сосудов занимает особое место в течение беременности [8].
Важнейшей целью васкуло- и ангиогенеза является адекватная доставка кислорода к тканям развивающегося зародыша. Трофобласт обладает своей системой детекции кислорода, которая в настоящий момент недостаточно изучена [9]. Однако идентифицированы некоторые сигнальные пути, которые предполагают участие АФК и транскрипционных факторов, таких как HIF — гипоксия-индуцибельный фактор [10]. Активация HIF приводит к его связыванию с ДНК, привлечению тканеспецифических кофакторов и трансактивации генов-мишеней, которые находятся под контролем уровня содержания кислорода: факторов роста (HIF-1 является ведущим активатором VEGF и PLGF), эритропоэтина и других сигнальных субстанций, вовлеченных в развитие гипоксического ответа [9, 11].
Среди всех ангиогенных факторов семейство сосудистых эндотелиальных факторов роста (VEGF) считается основным в новообразовании сосудов [12]. Белки, относящиеся к семейству VEGF, представляют собой гликопротеины, стимулирующие формирование новых кровеносных и лимфатических сосудов. Взаимодействие между VEGF и рецептором активирует остаток тирозина, находящегося в интрацитоплазматической части рецептора и запускает различные сигнальные каскады в эндотелиальных клетках, такие как пролиферация, миграция и увеличение сосудистой проницаемости [13]. Клетки трофобласта экспрессируют VEGF, обеспечивая дифференцировку, миграцию и пролиферацию клеток, формирование, рост и развитие сосудистой сети в период васкуло- и ангиогенеза.
Углубленное изучение состояния фетоплацентарного комплекса, особенностей его реакций в ответ на гипоксию на фоне незрелости организма несовершеннолетних может помочь выявить основные направления профилактики определенных осложнений беременности и родов у несовершеннолетних, в первую очередь плацентарной недостаточности, гестоза, гипоксии плода. В общедоступной литературе нам не удалось обнаружить работ, посвященных иммуногистохимическим исследованиям экспрессии маркера гипоксии HIF-1α или VEGF-А в плацентах несовершеннолетних женщин.
Фрагментарные данные литературы послужили основанием для настоящего исследования.
Целью данной работы было изучить особенности гистологического строения плацент и экспрессии маркеров HIF-1α и VEGF-А в плацентах несовершеннолетних женщин.
Материалы и методы исследования
Гистологическим методом было исследовано 74 последа от несовершеннолетних пациенток. Группу сравнения составили 25 последов от здоровых женщин среднего репродуктивного возраста (20–30 лет).
Плаценты исследовались по стандартизованной схеме [2], включающей макроскопический анализ, вырезку материала и гистологическое исследование. Проводилось взвешивание и осмотр плацент. При этом определялась форма, количество долек, тип развития сосудов, место прикрепления пуповины. Производилась вырезка материала: 6 кусочков плацентарной ткани (2 — из краевой, 2 — из парацентральной и 2 — из центральной зон), также отбиралась средняя часть пуповины и спираль из плодных оболочек.
После взятия материал фиксировался в 10 % растворе нейтрального забуференного формалина в течение 24 часов. В последующем образцы обезвоживали в спиртах возрастающей концентрации (70–95 %), помещали в ксилол и заливали в парафин с помощью автоматической станции Leica TP1020. Для гистологического исследования готовили парафиновые срезы толщиной 3–7 мкм. Для обзорной окраски использовали гематоксилин и эозин. При световой микроскопии с помощью микроскопа Olympus CX-31 (Япония) оценивалась плацента: строение виллезного дерева, компенсаторно-приспособительные реакции, состояние сосудистого русла и пластинок плаценты (базальная, хориальная), наличие или отсутствие воспалительных и дистрофических изменений в плаценте. Плодовые оболочки: соотношение анатомических составляющих (амниотический слой, трофобластический эпителий, децидуальная оболочка), наличие воспалительной реакции и дистрофических изменений. Пуповина: состояние Вартонова студня, количество и состояние сосудистого русла, наличие воспалительных изменений.
В иммуногистохимическое исследование были включены 35 плацент от несовершеннолетних пациенток, которые были разделены на три группы в зависимости от возраста: I группа (13–15 лет) — 8 плацент, II группа (16 лет) — 14 плацент, III группа (17 лет) — 16 плацент. В зависимости от наличия или отсутствия хронической плацентарной недостаточности (ХПН) несовершеннолетние пациентки также были разделены на две группы. Первую группу составили 11 плацент от несовершеннолетних пациенток с ХПН, вторую группу — 13 плацент от несовершеннолетних пациенток без ХПН по данным гистологического исследования.
Для изучения состояния сосудистого русла виллезного дерева плацент использовали моноклональные антитела эндотелиального сосудистого фактора роста VEGF-А (Clone UG1; 1 : 50, Dako), для оценки гипоксии в плаценте использовали антитела к маркеру гипоксия-индуцибельный фактор HIF-1α (H1 alpha 67; 1 : 100, GRTP (Abcam)).
Иммуногистохимическое исследование проводили на парафиновых срезах толщиной 5 мкм, помещенных на предметные стекла, покрытые пленкой из поли-L-лизина (Sigma). В качестве системы визуализации использовали набор Dako Cytomation LSAB2 System-HRP (Dako). Негативный контроль выполнен с применением блокирующей сыворотки (DAKO LSAB2 kit). Для проведения иммуногистохимической реакции использовали стандартный одноэтапный протокол с демаскировкой антигена (высокотемпературной обработкой ткани) в 0,01 М цитратном буфере (рН 7,6).
Методика для визуализации иммуногистохимической реакции выполнялась по стандартной схеме [14].
Для оценки результатов иммуногистохимического исследования проводили морфометрическое исследование с использованием системы компьютерного анализа микроскопических изображений, состоящей из микроскопа Olympus, цифровой камеры Olympus-BX46 и программного обеспечения СellSens Entry. В каждом случае анализировали 5 полей зрения при увеличении ×400 [15]. Из фотосъемки исключались поля зрения, содержащие дефекты ткани, дефекты окрашивания и артефакты. Дальнейшее количественное исследование проводили с помощью программы компьютерного анализа изображений Морфология 5.0 (ВидеоТест, Россия). При наличии положительной реакции на антитела было измерено два параметра: оптическая плотность и площадь экспрессии. Оптическая плотность выражалась в у. е.
Площадь экспрессии рассчитывали как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах для маркеров с цитоплазматическим окрашиванием и как отношение площади, занимаемой иммунопозитивными ядрами к общей площади ядер в поле зрения для маркеров с ядерной экспрессией.
Статистический анализ полученных данных проводился с использованием программы STATISTICA 6.1 (Statsoft Inc., Tulsa, США). Определение достоверности различий между сравниваемыми группами по частотам проводили с помощью критерия Фишера (F) или хи-квадрат (χ2) по стандартной формуле. Для оценки различий значений клинических параметров между различными группами применялся U-критерий Манна – Уитни или t-критерий Стьюдента для независимых выборок. Регрессионный статистический анализ проводился с использованием коэффициента Пирсона для оценки линейной корреляции и коэффициентов Кендалла и Спирмена для учета возможной нелинейности взаимосвязи. Значение p < 0,05 принималось как статистически значимое, значение p < 0,1 расценивалось как тенденция.
Результаты исследования
Основные клинико-морфологические характеристики фетоплацентарной системы несовершеннолетних беременных женщин и женщин среднего репродуктивного возраста представлены в таблице 1.
Таблица 1. Основные клинико-морфологические характеристики фетоплацентарной системы несовершеннолетних беременных женщин и женщин среднего репродуктивного возраста
Table 1. The main clinical and morphological characteristics of the feto-placental system in minor pregnant women and women of average age
Клинико-морфологические | Несовершеннолетние | Женщины среднего репродуктивного возраста |
Возраст, лет | 16,3 ± 0,2* | 26,3 ± 0,7 |
Срок родов, нед. | 39,2 ± 0,2 | 39,4 ± 0,2 |
Масса новорожденных, г | 3391,8 ± 53,9 | 3492,4 ± 42,5 |
Длина новорожденных, см | 51,3 ± 0,3 | 51,7 ± 0,3 |
Оценка по шкале Апгар | 7–8 | 7–8 |
Масса последа, г | 559,5 ± 10,5* | 478,7 ± 12,9 |
Плацентарно-плодовый коэффициент | 0,17 ± 0,003* | 0,14 ± 0,003 |
Примечание. * p < 0,001 при сопоставлении между группами | ||
Следует отметить, что масса плацент в группе несовершеннолетних составила 559,5 ± 10,5 г, что было достоверно больше, чем масса в группе женщин среднего репродуктивного возраста (478,7 ± 12,9) (p < 0,001). Плацентарно-плодовый коэффициент в группе несовершеннолетних составил 0,17 ± 0,003, что было достоверно больше, чем плацентарно-плодовый коэффициент в группе женщин среднего репродуктивного возраста (0,14 ± 0,003) (p < 0,001).
В таблице 2 представлены основные гистологические характеристики последов несовершеннолетних беременных женщин и женщин среднего репродуктивного возраста.
Таблица 2. Основные гистологические характеристики последов несовершеннолетних беременных женщин и женщин среднего репродуктивного возраста
Table 2. The main histological characteristics of placentas in minor pregnant women and women of average age
Гистологические | Несовершеннолетние (n = 74) | Женщины среднего репродуктивного возраста (n = 25) |
Терминальный тип развития виллезного дерева (плацента соответствует сроку гестации) | 49 (66,2 %)* | 23 (93,0 %) |
Степень циркуляторных нарушений: • слабая; • умеренная; • выраженная; | 14 (19,0 %) 30 (40,5 %) 30 (40,5 %)* | 4 (16,0 %) 18 (72,0 %) 3 (12,0 %) |
Компенсаторно-приспособительные изменения (умеренно выраженные) | 64 (86,5 %)* | 25 (100 %) |
Хроническая плацентарная недостаточность: • диссоциированная форма; • гиперпластическая форма | 25 (33,8 %)* 21 (28,4 %) 4 (5,4 %) | 1 (4,0 %) 1 (4,0 %) 0 |
Воспалительные изменения: • экссудативный характер воспаления: • 1-я стадия (мембранозная); • 2-я стадия (поражение оболочек и плаценты); • 3-я стадия (пуповинная); • продуктивный характер воспаления | 26 (35,1 %)* 19 (25,7 %) 6 (8,1 %) 7 (9,5 %) 6 (8,1 %) 7 (9,5 %) | 0 |
Примечание. * p < 0,05 при сопоставлении между группами | ||
В группе несовершеннолетних строение плаценты соответствовало сроку гестации в 49 (66,2 %) случаях, что было достоверно меньше, чем в группе женщин среднего репродуктивного возраста (23 (93,0 %)) (p < 0,05). Следует отметить достоверную разницу (p < 0,05) в частоте встречаемости выраженной степени циркуляторных нарушений между группами: 30 (40,5 %) случаев в группе несовершеннолетних и только 3 (12,0 %) случая в группе женщин среднего репродуктивного возраста (в этой группе все случаи выраженных циркуляторных нарушений в плаценте были обусловлены кесаревым сечением). Компенсаторно-приспособительные изменения в плацентах несовершеннолетних пациенток встречались достоверно реже в (64 случая, 86,5 %, p < 0,05), чем в плацентах женщин среднего репродуктивного возраста (25 (100 %) случаев), и были умеренно выражены. Во всех плацентах изменения характеризовались небольшим количеством синцитиальных узелков, сохранением просвета интервиллезного пространства с умеренным кровенаполнением, отсутствием ишемических и геморрагических инфарктов.
Диссоциированная форма ХПН была диагностирована в 21 (28,4 %) случае и характеризовалась нарушением созревания виллезного дерева с персистенцией промежуточных зрелых ворсин хориона и уменьшением числа ворсин терминального типа (рис. 1). В 4 (5,4 %) случаях был выявлен гиперпластический тип хронической плацентарной недостаточности, характеризующийся обилием мелких терминальных ворсин в плаценте (рис. 2).
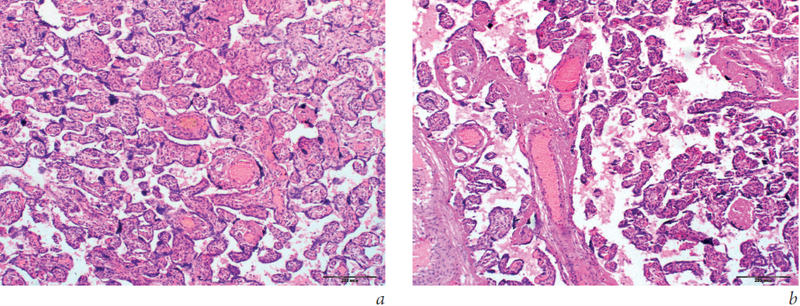
Рис. 1. Хроническая плацентарная недостаточность, субкомпенсированная стадия: a — преимущественно промежуточный тип развития виллезного дерева с неравномерным кровенаполнением сосудистого русла ворсин, полнокровием вен промежуточных ворсин и относительным малокровием терминальных ворсин хориона; b — дилатация, полнокровие вен и спазм артерий стволовых ворсин, относительное малокровие терминальных ворсин хориона. Г-Э, ×100
Fig. 1. Chronic placental insufficiency, subcompensated stage: a — Advantageously intermediate type of villous tree with uneven development of hyperemia of vascular in villi, congestion of veins in intermediate villi and a relative anemia in terminal chorionic villi; b — Dilation, congestion of veins and arteries spasm in stem villi, the relative anemia in terminal chorionic villi. G-E, ×100
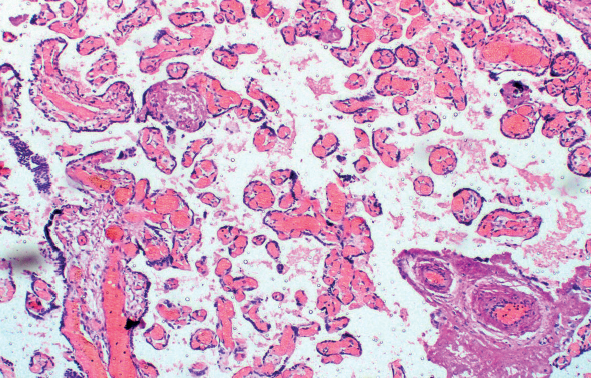
Рис. 2. Хроническая плацентарная недостаточность, гиперпластическая форма. Гиперваскуляризация и полнокровие сосудистого русла промежуточных и терминальных ворсин хориона с диапедезом эритроцитов в строму ворсин. Г-Э, ×100
Fig. 2. Chronic placental insufficiency, hyperplastic form.
Hypervascularisation and vascular congestion in intermediate and terminal chorionic villi with the diapedesis of red blood cells in the stroma of villi. G-E, ×100
Воспалительные изменения в последах группы несовершеннолетних были выявлены в 26 (35,1 %) случаях и носили экссудативный (19 (25,7 %) случаев) и продуктивный (7 (9,5 %) случаев) характер, при этом воспалительных изменений в последах женщин среднего репродуктивного возраста выявлено не было (p < 0,05). Частота выявления экссудативного воспалительного процесса с вовлечением только плодных оболочек (бактериальное инфицирование 1-й стадии, мембранозной) и всех составляющих последа (бактериальное инфицирование 3-й стадии, пуповинной) составила 6 (8,1 %) случаев для мембранозной стадии и 7 (9,5 %) случаев для пуповинной. В структуре экссудативного воспалительного процесса преобладало поражение плодных оболочек (париетальный хориодецидуит и мембранит) и плаценты (субхориальный интервиллузит, плацентарный хориоамнионит) в 10 (13,5 %) случаях, в то время как воспалительные изменения в пуповине (флебофуникулит и сосудисто-стромальный фуникулит) присутствовали в 7 (9,5 %) случаях. Гематогенная инфекция в последах была диагностирована в 7 (9,5 %) случаях и проявлялась развитием диссеминированного продуктивного виллузита в 3 (11,5 %) случаях и продуктивного децидуита с париетальной и базальной локализацией в 4 (15,4 %) случаях от общего числа воспалительных изменений в последах несовершеннолетних.
Результаты иммуногистохимического исследования плацент от несовершеннолетних женщин в зависимости от возраста представлены в таблице 3.
Таблица 3. Экспрессия гипоксия-индуцибельного фактора-1 (HIF-1α) в плацентах в зависимости от возраста женщин
Table 3. Expression of hypoxia-inducible factor-1 (HIF-1α) in placentas depending on the age of women
Возраст | Площадь экспрессии, % | Оптическая плотность, у. ед. |
13–15 лет (n = 8) | 8,5 ± 1,5 | 0,10 ± 0,01 |
16 лет (n = 14) | 11,2 ± 2,4 | 0,09 ± 0,006 |
17 лет (n = 16) | 7,8 ± 0,7 | 0,10 ± 0,009 |
Как видно из таблицы 3, межгрупповое сравнение площади экспрессии и оптической плотности экспрессии HIF-1α не выявило статистически значимых отличий. Для последующего анализа иммуногистохимического исследования экспрессии HIF-1α были выделены группы с гистологически установленной ХПН, данные представлены в таблице 4.
Таблица 4. Экспрессия гипоксия-индуцибельного фактора-1 (HIF-1α) в плацентах в зависимости от наличия хронической плацентарной недостаточности
Table 4. Expression of hypoxia-inducible factor -1 (HIF-1α) in placentas depending on the availability of chronic placental insufficiency
Группа | Площадь экспрессии, % | Оптическая плотность, у. ед. |
С хронической плацентарной недостаточностью (n = 11) | 11,4 ± 2,9 | 0,10 ± 0,003 |
Без хронической плацентарной недостаточности (n = 13) | 8,2 ± 0,93 | 0,08 ± 0,0001 |
При сравнении внутри групп отмечалась тенденция к повышению площади экспрессии и оптической плотности HIF-1α в плацентах с ХПН.
В таблице 5 представлена экспрессия сосудистого эндотелиального фактора роста (VEGF-A) в плацентах в зависимости от возраста женщин.
Таблица 5. Экспрессия сосудистого эндотелиального фактора роста – A (VEGF-A) в плацентах в зависимости от возраста женщин
Table 5. Expression of vascular endothelial growth factor (VEGF-A) in placentas depending on the age of women
Возраст | Площадь экспрессии, % | Оптическая плотность, у. ед. |
13–15 лет (n = 8) | 16,8 ± 0,99 | 0,12 ± 0,006 |
16 лет (n = 14) | 15,3 ± 1,3 | 0,12 ± 0,004 |
17 лет (n = 16) | 17,7 ± 0,7 | 0,12 ± 0,004 |
Как видно из представленных данных, при межгрупповой оценке площади экспресии и оптической плотности маркера VEGF-A значимых отличий не отмечалось.
Сравнительная оценка экспрессии данного маркера в плацентах в зависимости от наличия или отсутствия ХПН представлена в таблице 6.
Таблица 6. Экспрессия сосудисто-эндотелиального фактора роста – A (VEGF-A) в плацентах зависимости от наличия хронической плацентарной недостаточности
Table 6. Expression of vascular endothelial growth factor – A (VEGF-A) in placentas depending on the availability of chronic placental insufficiency
Группа | Площадь экспрессии, % | Оптическая плотность, у. ед. |
С хронической плацентарной недостаточностью (n = 11) | 17,6 ± 0,004 | 0,13 ± 0,004 |
Без хронической плацентарной недостаточности (n = 13) | 15,3 ± 1,3 | 0,12 ± 0,004 |
При сравнении внутри групп отмечалась тенденция к повышению площади экспрессии и оптической плотности VEGF-A в плацентах с ХПН.
По результатам корреляционного анализа с использованием коэффициента линейной корреляции Пирсона не было выявлено значимой взаимосвязи между возрастом, площадью экспрессии и оптической плотностью маркеров HIF-1α и VEGF-A (p > 0,05). Также не было выявлено значимой линейной взаимосвязи между площадью экспрессии одного и другого маркера, а также оптической плотностью обоих маркеров (p > 0,05).
Однако в соответствии с коэффициентами корреляции Кендалла и Спирмена наблюдается статистически значимая слабоотрицательная взаимосвязь между площадью экспрессии и оптической плотностью маркера HIF-1α (коэффициент Кендалла — – 0,230, коэффициент Спирмена — – 0,348, в обоих случаях p < 0,05).
Заключение
Гистологическое исследование последов несовершеннолетних женщин и женщин среднего репродуктивного возраста не выявило достоверных различий между группами в массо-ростовых показателях детей и их оценке по шкале Апгар. Однако результаты исследования показали, что гистологическое строение плацент у несовершеннолетних беременных женщин, по сравнению с женщинами среднего репродуктивного возраста, характеризуется достоверной гипертрофией и большей частотой ХПН с выраженной степенью циркуляторных нарушений. В плаценте несовершеннолетних женщин степень компенсаторно-приспособительных реакций была ниже и достоверно чаще выявлялись воспалительные изменения.
ХПН на момент рождения ребенка, выявляемая чаще у несовершеннолетних пациенток, может иметь значение в нарушении адаптационно-приспособительных механизмов и качестве жизни детей в постнатальном периоде. Следует также отметить, что масса плаценты и плацентарно-плодовый коэффициент в группе несовершеннолетних женщин по сравнению с женщинами среднего репродуктивного возраста были достоверно выше, что может указывать на неблагоприятные условия внутриутробного развития плода и плодово-плацентарных взаимоотношений у несовершеннолетних беременных женщин.
Проведенное иммуногистохимическое исследование выявило повышение экспрессии гипоксия-индуцибельного фактора (HIF-1α) и сосудисто-эндотелиального фактора роста — A (VEGF-A) в плацентах несовершеннолетних женщин с хронической плацентарной недостаточностью по сравнению с плацентами несовершеннолетних женщин без таковой. Изучаемые факторы служат отражением активации ангиогенеза в ответ на внутриутробную гипоксию плода в условиях хронической плацентарной недостаточности.
Авторы заявляют об отсутствии конфликтов интересов.
About the authors
Evgeny S Mikhaylin
North-Western State Medical University named after I.I. Mechnikov
Author for correspondence.
Email: mihailin@mail.ru
assistant of the department of obstetrics and gynecology Russian Federation
Gulrukhsor K Tolibova
FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott”
Email: mihailin@mail.ru
PhD, senior resecher of Laboratory of Cell biology, Department of Pathomorphology Russian Federation
Tatyana G Tral
FSBSI “The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott”
Email: mihailin@mail.ru
PhD, Pathologist, Head of Pathologis Laboratory, Department of Pathomorphology Russian Federation
References
- Гармашева Н.Л., Константинова H.H. Патофизиологические основы охраны внутриутробного развития человека. — Л.: Медицина, 1985. — 159 с. [Garmasheva NL, Konstantinova NN. Patofiziologiches¬kie osnovy okhrany vnutriutrobnogo razvitiya cheloveka. Leningrad: Meditsina; 1985. (In Russ.)]
- Милованов А.П. Патология системы мать — плацента — плод: руководство для врачей. — М., 1999. — 448 с. [Milovanov AP. Patologiya sistemy mat’ — platsenta — plod: rukovodstvo dlya vrachey. Moscow; 1999. (In Russ.)]
- Гуркин Ю.А., Суслопаров Л.А., Островская Е.А. Основы ювенильного акушерства. — СПб.: Фолиант, 2001. [Gurkin YuA, Susloparov LA, Ostrovskaya EA. Osnovy yuvenil’nogo akusherstva. Saint Petersburg: Foliant; 2001. (In Russ.)]
- Кротин П.Н. Научное обоснование службы охраны репродуктивного здоровья девушек-подростков: автореф. дис. д-ра мед. наук. — СПб., 1998. — 39 c. [Krotin PN. Nauchnoe obosnovanie sluzhby okhrany reproduktivnogo zdorov’ya devushek-podrostkov. [dissertation]. Saint Petersburg; 1998. (In Russ.)]
- Иванов Д.О., Петренко Ю.В., Кашменская В.Н. Особенности ангиогенеза у новорожденных с ЗВУР // Детская медицина Северо-Запада. — 2013. — Т. 4. — № 4. — С. 4–10. [Ivanov DO, Petrenko YuV, Kashmenskaya VN. Features angiogenesis in newborns with IUGR. Detskaya meditsina Severo-Zapada. 2013;4 (4):4-10. (In Russ.)]
- Pardanaud L, Yassine F, Dieterlen-Lievre F. Relationship between vasculogenesis, angiogenesis and haemopoiesis during avian ontogeny. Development. 1989;105(3):473-485.
- Urbich C, Dimmler S. Endotelial progenitor cells: characterization and role in vascular biology. Circ Res. 2004;95:343-353. doi: 10.1161/01.RES.0000137877.89448.78.
- Polin R, Fox W, Abman S. Fetal and Neonatal Physiology: Expert Consult (2-Volume Set). Philadelphia: Elsiver; 2011.
- Caniggia I, Winter J. Hypoxia inducible factor-1: oxygen regulation of trophoblast differentiation in normal and pre-eclamptic pregnancies. Placenta. 2002; 23:47-57. doi: 10.1053/plac.2002.0815.
- DeMarco CS, Caniggia I. Mechanisms of oxygen sensing in human trophoblasts. Placenta. 2002;23:58-68. doi: 10.1053/plac.2002.0809.
- Соснина А.К., Траль Т.Г., Крылова Ю.С. Функциональная морфология виллезного дерева плацент при доношенной одноплодной беременности, достигнутой методами вспомогательных репродуктивных технологий // Журнал акушерства и женских болезней. — 2016. — Т. LXV. — Вып. 3. — С. 49–57. [Sosnina AK, Tral’ TG, Krylova YuS. Functional morphology of the placentas villous tree at term singleton pregnancies achieved by methods of assisted reproductive technology. Journal of Obstetrics and Women´s Diseases. 2016;65(3):49-57. (In Russ.)]. doi: 10.17816/JOWD65349-57.
- Ferrara N. VEGF-A: a critical regulator of blood vessel growth. Eur Cytokine Netw. 2009;20(4):158-63. doi: 10.1684/ecn.2009.0170.
- Guo S, Colbert LS, Fuller M, et al. Vascular endothelial growth factor receptor-2 in breast factor. Biochim Biophys Acta. 2010;1806(1):108-121. doi: 10.1016/j.bbcan.2010.04.004.
- Петров С.В., Райхлин Н.Т. Руководство по иммуногистохимической диагностике опухолей человека. — Казань: Титул, 2004. — 452 с. [Petrov SV, Raykhlin NT. Rukovodstvo po immunogistokhimicheskoy diagnostike opukholey cheloveka. Kazan’: Tytul; 2004. (In Russ.)]
- Автандилов Г.Г. Медицинская морфометрия. Руководство. — М.: Медицина, 1990. — 384 с. [Avtandilov GG. Meditsinskaya morfometriya. Rukovodstvo. Moscow: Meditsina; 1990. (In Russ.)]
Supplementary files







