Hypertension and endothelial dysfunction in comorbid pathology: diabetes mellitus and primary hypothyriodism
- Issue: Vol 24, No 4 (2016)
- Pages: 42-55
- Section: Articles
- Submitted: 28.02.2017
- Published: 15.12.2016
- URL: https://journals.eco-vector.com/pavlovj/article/view/6068
- DOI: https://doi.org/10.23888/PAVLOVJ2016442-55
- ID: 6068
Cite item
Full Text
Abstract
Full Text
Артериальная гипертензия (АГ) является одним из самых значимых факторов риска развития и прогрессирования диабетических микро- и макроангиопатий. По данным эпидемиологических исследований при сочетании сахарного диабета (СД) и АГ риск развития инфаркта миокарда возрастает в 3-5 раз, инсульта - в 3-4 раза, полной потери зрения - в 10-20 раз, уремии - в 2025 раз, гангрены нижних конечностей - в 20 раз [1]. По результатам скрининга, проведенного в рамках реализации Федеральной целевой программы «Сахарный диабет», частота АГ составляет 50% при СД 1 типа и 80-90% при СД 2 типа [2].
При СД 1 типа патогенез АГ на 8090% связан с развитием диабетической нефропатии (ДН). Ведущий механизм формирования АГ при ДН связан с повышенной реабсорбцией и низкой экскрецией натрия в почечных канальцах, что ведет к повышению концентрации ионообменного натрия приблизительно на 10% и, соответственно, накоплению жидкости во внутри- и внеклеточном пространстве с развитием гиперволемии. Вместе с повышением содержания натрия происходит накопление ионов кальция в стенках сосудов, что увеличивает аффинность рецепторов сосудов к катехоламинам и другим констрикторным факторам (ангиотен-зину II, эндотелину-1). Это способствует спазму и повышению общего периферического сопротивления (ОПСС).
АГ при СД 2 типа является составляющей синдрома инсулинорезистентно-сти. Гиперинсулинемия способствует активации симпатической нервной системы с увеличением сердечного выброса и ОПСС, повышению реабсорбции натрия и жидкости в почках, внутриклеточному накоплению натрия и кальция. Кроме того, инсулин является митогенным фактором, активирующим пролиферацию гладкомышечных клеток сосудов, что ведет к утолщению стенки сосудов и повышению ОПСС.Активность локальной (почечной) ренин-ангиотензиновой системы имеет большое значение в развитии системной и внутриклубочковой АГ при СД 1 и 2 ти-па.Гипергликемия также поддерживает высокую осмолярность крови, способствуя развитию гиперволемии и увеличению сердечного выброса.
В последние годы в патогенезе развития поражения сердечно-сосудистой системы доминирующее место отводят эндотелиальной дисфункции [3]. В настоящее время эндотелиальные клетки сосудов рассматриваются не только как барьерный, но и мощный эндокринный орган, продуцирующий различные биологически активные вещества: сосудорасширяющие и сосудосуживающие, про- и антитромботические факторы, активаторы и ингибиторы фибри-нолиза, факторы роста и пролиферациии другие. Многие авторы считают нарушение свойств эндотелия одним из основных механизмов формирования АГи ее осложне-ний.С позиций других авторов, сама АГ является сильным фактором патологического воздействия на эндотелий сосудов: под влиянием высокого гидравлического давления происходит механическое повреждение клеток эндотелия и нарушение синтеза вазоактивных веществ [4].
Среди биологически активных веществ, участвующих в регуляции артериального давления и продуцируемых эндотелием, важнейшим, безусловно, является оксид азота (NO), который в физиологических условиях нетолько служит мощным вазодилататором, но и модулирует высвобождение других вазоактивных медиаторов, ингибирует адгезию лейкоцитов, агрегацию тромбоцитов, пролиферацию гладкомышечных клеток, подавляет экспрессию провоспалительных генов. Вследствие высокой нестабильности молекулы NO прямое измерение его концентрации в плазме затруднительно, поэтому для оценки NO-синтетической функции эндотелия часто используются непрямые методы: измерение уровня стабильных метаболитов NO (нитратов и нитритов) в сыворотке крови и моче или ангиографические и ультразвуковые (УЗ) методики - инвазивные (например, с использованием ацетилхолина) и неинвазивные. Доступнее применение неинвазивной УЗ-методики, при которой вазомоторная функция коронарных артерий оценивается по состоянию плечевой или поверхностной бедренной артерии. Метод основан на способности эндотелия в условиях механической пробы с реактивной гиперемией высвобождать N0, что, соответственно, приводит к вазо-дилатации. Нормальным ответом эндотелия считается прирост диаметра плечевой артерии (Ad) более 10% от исходного.
В развитии АГ с позиций эндотелиальной дисфункции играет роль не только уменьшение продукции N0 сосудистой стенкой, но также активация локальной секреции вазоконстрикторов - эндотели-на-1 (Э-1), ангиотензина II и других. Э-1 -пептид эндотелиального происхождения, ему присущи следующие свойства: сосудосуживающее действие (вазоконстрик-торный эффект превышает таковой у но-радреналина в 100 раз, ангиотензина II- в 10 раз) [5], стимуляция пролиферации гладкомышечных клеток, ингибирование фибринолиза, стимуляция адгезии лейкоцитов к поверхности эндотелия, что способствует участию Э-1 в развитии воспаления и атеросклероза. Наиболее значимым является вазоконстрикторный эффект Э-1, механизм которого заключается во взаимодействии Э-1 с эндотелиновым рецептором-А, находящимся на поверхности гладкомышечных клеток сосудов, далее происходит активация G-белков и фосфолипазы С с последующим повышением концентрации кальция в гладкомышечных сосудистых клетках и развитием вазоконстрикции. Выявлено повышение уровня Э-1 в крови у больных стенокардией, инфарктом миокарда, артериальной гипертензией, сахарным диабетом [6].
Наряду с сахарным диабетом заболевания щитовидной железы имеют высокую распространенность и тенденцию к росту. Общая распространенность манифестного гипотиреоза по данным различных эпидемиологических исследований составляет от 0,8 до 10%, субклинического гипотиреоза - от 1 до 15% [7]. Частота гипотиреоза у больных СД значительно выше, чем в общей популяции, и составляет по данным разных авторов от 6,9% до 35%, субклинического - от 8,6 до 31% [8]. Известно, что наличие сопутствующего гипотиреоза ухудшает показатели липидного спектра, углеводного обмена [9], тем самым способствует прогрессированию сосудистых осложнений.
Вопреки традиционным представлениям о том, что гипотиреоз сопровождается артериальной гипотензией, в 90-х годах ХХ века P. Landerson впервые указал, что АГ при первичном гипотиреозе является распространенным явлением. В настоящее время известно, что АГ при первичном гипотиреозе встречается от 20% до 35% и носит преимущественно диастолический характер [10], что связано в основном с повышением ОПСС (мукоидный отек, снижение эластичности сосудистой стенки), задержкой натрия и воды за счет избытка гликозаминогликанов и вазопрес-сина в тканях, снижением эндотелий-зависимой вазодилатации и натрийурети-ческого пептида, уменьшением прямого вазодилатирующего эффекта трийодтиро-нина при недостатке тиреоидных гормонов. Было показано, что степень АГ при гипотиреозе в фазе медикаментозной субкомпенсации положительно коррелирует с длительностью АГ и уровнем тиреотропного гормона (ТТГ) [11].
В настоящее время получены данные о развитии эндотелиальной дисфункции на фоне гипотиреоза. Так, согласно публикации Lekakis et al., отмечено снижение эндотелий-зависимой вазодилата-ции (ЭЗВД) плечевой артерии как у пациентов с ТТГ более 10 мМЕ/л, так и у пациентов с ТТГ от 4,01 до 10 мМЕ/л в сравнении с контролем [12]. Выявлены статистически значимо более высокие концентрации Э-1 и других маркеров дисфункции эндотелия (ДЭ) у пациентов с манифестным и субклиническим гипотиреозом [13]. Среди причин снижения ЭЗВД указывается возможное повреждающее действие иммунных комплексов на фоне аутоиммунного тиреоидита (АИТ), дефицит трийодтиронина, влияние гиперлипидемии на состояние сосудистого эндотелия при гипотиреозе [14, 15].
Цель: изучение особенностей артериальной гипертензии и нарушения функции эндотелия у больных сахарным диабетом 1 и 2 типа в сочетании с первичным гипотиреозом.
Материалы и методы
В эндокринологическом отделении ГБУ РО ОКБ обследовано 63 больных СД 1 и 2 типа и артериальной гипертензией 23 степени. Из них 1 группа, 38 человек -СД 1 и 2 типа в сочетании с первичным гипотиреозом (АИТ - у 21 чел., послеоперационный гипотиреоз - 17 чел.). Средний возраст 57,6±1,7 лет, длительность СД -9,6±0,9 лет, индекс массы тела (ИМТ) -31,8±1,2 кг/м2. 2 группа - 25 больных СД 1 и 2 типа без патологии щитовидной железы. Средний возраст 57,8±1,3 лет, длительность СД - 10,1±1,2 лет, ИМТ - 34,4±1,0 кг/м2. ТТГ в 1-й группе на фоне заместительной терапии левотироксином (50-200 мкг/сут) составил 5,1±0,8 мкМБ/мл, во 2-й группе - 1,3±0,1 мкМБ/мл (р<0,001); уровень тетрайодтиронина (св. Т4) - 15,4±0,2 и 14,1±0,5 пмоль/л соответственно в 1-й и 2-й группе, р>0,05 (табл. 1).
Пациенты обеих групп получали сахароснижающую терапию пероральными препаратами (метформин, гликлазид МВ, гли-мепирид, вилдаглиптин, саксаглиптин) в виде монотерапии, комбинированной пероральной терапии и в сочетании с инсулином или инсулинотерапию в базал-болюсном режиме (инсулин гларгин, детемир, аспарт, глулизин). В качестве гипотензивной терапии использовались препараты: лизиноприл, периндоприл, лозартан, валсартан, индапа-мид, бисопролол, небиволол, амлодипин, дилтиазем, моксонидин в комбинации.
Таблица 1 Клиническая характеристика пациентов
1 группа 38 чел. | 2 группа 25чел. | Р | |
Средний возраст, лет | 57,6±1,7 | 57,8±1,3 | р>0,05 |
Длительность СД, лет | 9,6±0,9 | 10,1±1,2 | р>0,05 |
Длительность гипотиреоза, лет | 8,4±0,6 | - | - |
Длительность АГ, лет | 8,2±0,7 | 9,5±0,4 | р>0,05 |
ИМТ, кг/м2 | 31,8±1,2 | 34,0±1,0 | р>0,05 |
ТТГ, мкМE/мл | 5,1±0,8 | 1,3±0,1 | р<0,001 |
Св. Т4, пмоль/л | 15,4±0,2 | 14,1±0,5 | р>0,05 |
Проведено исследование углеводного (гликемия натощак, постпрандиальная, НвА1с), липидного обмена - ОХС, ХС ЛПНП, ХС ЛПВП, триглицериды (ТГ), с вычислением индекса атерогенности (ИА), тиреотропного гормона (ТТГ), тироксина (св. Т4), инсулина (ИРИ), индекс инсулинорезистентности рассчитывали по формуле H0MA-IR (Homeostasismodelas-sessmentinsulinresistance). Уровень эндо-телина-1 определяли иммуноферментным методом в плазме крови (Biomedica Gruppe) в ЦНИЛ РязГМУ. Суточное мони-торирование артериального давления
(СМАД) проводилось по стандартной методике с помощью аппарата системы «Ва-лента». Оценку ЭЗВД проводили с помощью механического теста (манжеточной пробы). Использовали дуплексное сканирование плечевой артерии по методике D. Celermajer с соавт. (1992) на ультразвуковом сканере LOGIQbook XP (China) c помощью линейного датчика с частотой 7,5 МГц. Поток-зависимую дилатацию, как характеристику эндотелий-зависимого ответа, рассчитывали по отношению изменения диаметра плечевой артерии при реактивной гиперемии (после 5-минутного прекращения кровотока в конечности) к исходному диаметру артерии в диастолу, выраженному в процентах. Эндотелий-независимая вазодилатация (ЭНВД) оценивалась после сублингвального приема 500 мкг нитроглицерина. При исследовании ЭЗВД и Э-1 контрольную группу составили 12 человек без нарушений углеводного обмена и патологии щитовидной железы, сопоставимых по возрасту.
Для статистической обработки материала использовалась программа STA-TISTICA 6. Данные представлены в виде М±m. Связь между показателями устанавливали, используя t-критерий Стъюдента. Нормальность распределения проверялась критерием Колмогорова-Смирнова. Коэффициент корреляции r рассчитывали методом Спирмена. Статистически значимыми считали различия при р<0,05.
Протокол исследования одобрен Локальным этическим комитетом ФГБОУ ВО РязГМУ Минздрава России. Все пациенты добровольно подписали информированное согласие на включение в исследование.
Результаты и их обсуждение
При анализе показателей углеводного обмена уровень НвА1с составил в 1-й группе 8,9±0,2%, во 2-й группе - 8,0±0,2% (р<0,05), глюкоза крови натощак - 8,7±0,3 ммоль/л и 7,1±0,2 ммоль/л (р<0,05), пост-прандиальная гликемия - 11,2±0,3 и 8,6±0,4ммоль/л соответственно (р<0,05). При оценке уровня ИРИ у больных СД 2 типа выявлено достоверное повышение данного показателя в 1-й группе в сравнении со 2-й группой (16,9±1,8 и 10,7±1,5, р<0,05), а также индекса HOMA-IR (6,63±0,9 и 2,84±0,4, соответственно, р<0,01) (табл. 2), что согласуется с литературными данными: у больных СД 2 типа при дефиците тиреоидных гормонов в большинстве исследований, проведенных с использованием эугликемического гипе-ринсулинемического клэмпа и расчетом индекса HOMA-IR и Matsuda, обнаружено снижение утилизации глюкозы в мышечной и жировой ткани, обусловленное ин-сулинорезистентностью [16].
По данным большинства исследователей при гипотиреозе отмечается нарушение липидного обмена с повышением концентрации ОХС, ТГ, ХС ЛПНП, что объясняется уменьшением скорости распада липидов вследствие снижения активности ли-попротеидлипазы и ухудшением экскреции атерогенных фракций липидов с желчью [17]. При межгрупповом сравнении показателей липидного спектра у пациентов 1-й группы выявлено достоверное повышение ОХС в сравнении с 2-й группой (6,7±0,17 и 5,7±0,2 ммоль/л, р<0,01), ХС ЛПНП (4,3±0,04 и 3,4±0,2 ммоль/л, р<0,01), ТГ (4,2±0,2 и 2,2±0,2 ммоль/л, р<0,01) и ИА (5,1±0,08 и 3,8±0,2, р<0,01), а также умеренная тенденция к снижению ХС ЛПВП (1,1±0,2 и 1,25±0,1 ммоль/л, р>0,05) (табл. 2). Установлена сильная прямая корреляционная зависимость показателей ОХС (r=0,76, p=0,01) ХС ЛПНП (r=0,78, p=0,036), ТГ (r=0,82, p=0,02) и средняя ИА (r=0,68, p=0,006) от уровня ТТГ в группе больных СД в сочетании с гипотиреозом.
При анализе результатов СМАД средние показатели систолического (САД) и диастолического АД (ДАД) в дневное и ночное время у пациентов 1-й и 2-й групп существенно не различались и находились на фоне гипотензивной терапии в пределах нормальных значений. Однако индекс времени ДАД (гипер) был значительно повышен (более 50%) у пациентов обеих групп и составил: ДАД день - 86,9±7,3% и 68,5±5,6% (р<0,05); ДАД ночь - 87,2±7,1 и 69,8±5,8% (р<0,05), ДАД 24 ч - 87,1±7,0% и 68,6±6,2% (р<0,05) у пациентов 1-й и 2-й группы соответственно. Скорость утреннего подъема (СУП) САД и ДАД была умеренно повышена у пациентов обеих групп, что, по-видимому, связано с недостаточным снижением АД в ночные часы. Вариабельность САД и ДАД на фоне проводимой ан-тигипертензивной терапии не превышала нормальных значений (15 мм рт.ст.) у пациентов обеих групп (табл. 3).
У больных обеих групп отмечено нарушение циркадности ритма АД в виде недостаточного снижения САД и ДАД в ночные часы, что, по-видимому, обусловлено развитием диабетической автономной кардиоваскулярной нейропатии. Такой извращенный суточный ритм АД сопряжен с максимальным риском развития сердечно-сосудистых осложнений. Нормальный профиль САД - диппер зарегистрирован у пациентов 1-й группы в 17,6±2,8% случаев, во 2-й группе - более, чем в 2,3 раза чаще - 41,2±1,5% (р<0,05). Профиль нон-диппер, напротив, имел место в 2 раза чаще в 1-й группе - у 47,1±3,8% больных, во 2-й - лишь у 23,5±2,5% (р<0,05) (рис. 1)
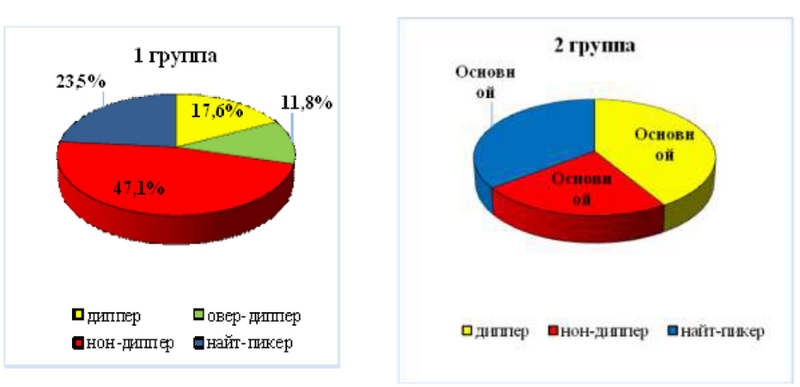
Рис. 1. Суточный индекс САД
Таблица 2. Показатели углеводного, липидного обмена и функции эндотелия
Показатель | 1 группа | 2 группа | Р |
НвА1с, % | 8,9±0,2 | 8,0±0,2 | р<0,05 |
Гликемия натощак, ммоль/л | 8,7±0,3 | 7,1±0,2 | р<0,001 |
Постпрандиальная гликемия, ммоль/л | 11,2±0,3 | 8,6±0,4 | р<0,001 |
ОХС, ммоль/л | 6,7±0,17 | 5,72±0,2 | р<0,01 |
ХС ЛПНП, ммоль/л | 4,3±0,04 | 3,4±0,2 | р<0,01 |
ХС ЛПВП, ммоль/л | 1,1±0,2 | 1,25±0,1 | р>0,05 |
Триглицериды, ммоль/л | 4,2±0,2 | 2,2±0,2 | р<0,01 |
Индекс атерогенности | 5,1±0,08 | 3,6±0,2 | р<0,01 |
ИРИ,мМЕ/л | 16,9±1,8 | 10,7±1,5 | р<0,05 |
H0MA-IR | 6,63±0,9 | 2,84±0,4 | р<0,01 |
Эндотелин-1, фмоль/мл | 1,56±0,09 | 0,88±0,07 | р<0,001 |
ЭЗВД, % | 11,4±1,2 | 18,1±1,1 | р<0,05 |
ЭНВД, % | 20,2±1,9 | 16,8±1,3 | p>0,05 |
Таблица 3. Показатели суточного мониторирования АД
Показатель | 1 группа | 2 группа | Р |
Среднее САД 24ч, мм. рт. ст. | 121,7±5,0 | 125,8±9,1 | р>0,05 |
Среднее ДАД, 24ч, мм. рт. ст. | 72,8±4,9 | 77,1±5,9 | р>0,05 |
Индекс времени САД гипер. 24ч, % | 18,1±1,1 | 20,5±2,6 | p>0,05 |
Индекс времени ДАД гипер. день, % | 86,9±7,3 | 68,5±5,6 | р<0,05 |
ночь, % | 87,2±7,1 | 69,8±5,8 | р<0,05 |
24ч, % | 87,1±7,0 | 68,6±6,2 | р<0,05 |
Вариабельность САД 24ч, мм. рт. ст. | 13,6±0,9 | 12,4±0,8 | р>0,05 |
Вариабельность ДАД 24ч, мм. рт. ст. | 9,9±0,8 | 11,3±1,0 | р>0,05 |
Суточный индекс САД, % | 6,7±0,8 | 4,9±0,6 | р>0,05 |
Суточный индекс ДАД, % | 8,5±0,9 | 6,3±0,8 | р>0,05 |
СУП САД, мм. рт. ст. | 6,8±0,5 | 11,2±1,2 | p<0,01 |
СУП ДАД, мм. рт. ст. | 6,3±0,4 | 11,2± 1,1 | p<0,01 |
Суточный индекс ДАД: нон-диппер в 1-й группе выявлен у 41,3±3,6%, во 2-ой - 35,3±2,5% (р>0,05), профиль диппер -больше во 2-й группе - 35,5±2,9% против 23,5±1,8% в 1-й группе (р<0,01) (рис. 2).
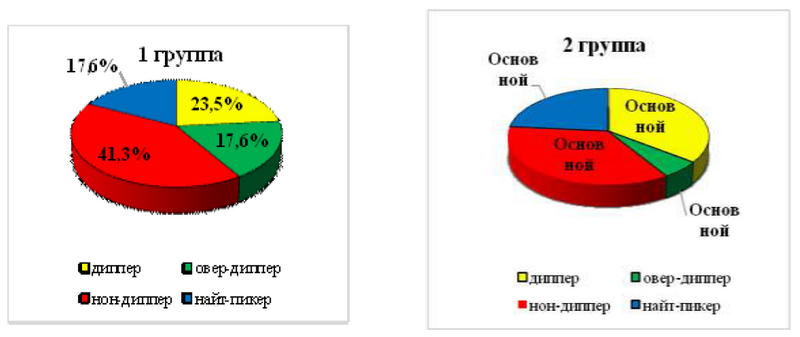
Рис. 2. Суточный индекс ДАД
При выполнении пробы с реактивной гиперемией прирост диаметра плечевой артерии после декомпрессии (Ad) был достоверно снижен у пациентов обеих групп в сравнении с контролем (26,3±1,7%) и составил в 1-й группе 11,4±1,7%, во 2-й -18,1±2,8% (р<0,05) (рис. 3). Показатель Ad менее 10%, указывающий на снижение ЭЗВД, выявлен у 45,5% больных в 1-й группе и у 31,5% во 2-й. При оценке синтетической функции эндотелия уровень Э-1 составил в 1-й группе - 1,56±0,09, во 2-й группе - 0,88±0,07 фмоль/мл (р<0,001), в контроле - 0,65±0,1 фмоль/мл, (рис. 4), референсные значения - менее 0,26 фмоль/мл. Полученные результаты указывают на более выраженные изменения сосудодвигательной и синтетической функции эндотелия у больных сочетанной патологией и согласуются с литературными данными. Так, в работе В.В. Самитина с соавт. было показано, что при субклиническом гипотиреозе степень нарушения сосудодвига-тетельной функции эндотелия, определяемая по уровню ЭЗВД плечевой артерии, коррелировала с уровнем ТТГ [18]. В нашем исследовании у больных 1-й группы также выявлена корреляционная зависимость между уровнем ТТГ и параметрами функции эндотелия: ТТГ и Ad: r= -0,46, p=0,041; ТТГ и Э-1: r=0,36, p=0,067.
При проведении корреляционного анализа у больных обеих групп выявлена достоверная обратная зависимость между показателями ЭЗВД (Ad) и Э-1 (r=-0,67, p=0,006), что указывает на возможное отрицательное влияние повышенного уровня Э-1 на продукцию N0 или на ингибирование его вазодилатирующего эффекта [19].

Рис. 3. ЭЗВД (Ad) при проведении пробы с реактивной гиперемией

Рис. 4. Уровень Эндотелина-1
При оценке взаимного влияния АГ и ДЭ выявлены корреляционные связи параметров СМАД и ДЭ (табл. 4). В большей степени отмечена взаимосвязь ЭЗВД и Э-1 с показателями САД и суточным индексом САД и ДАД, что может свидетельствовать в пользу гипотезы о патологическом воздействии высокого гидравлического давления на эндотелий сосудов, приводящего к механическому повреждению клеток эндотелия.
Среди факторов, влияющих на функцию эндотелия, логично предположить влияние возраста и ИМТ с учетом прогрессирования атеросклеротических процессов и повышения жесткости артерий. При проведении корреляционного анализа выявлена отрицательная зависимость ЭЗВД и возраста пациентов: r=-0,53, p=0,032; ЭЗВД и ИМТ: r= -0,38, p=0,042. Связь ЭЗВД и длительности СД отмечена только у больных СД2 типа, что нельзя сказать о пациентах с СД1 типа, это не противоречит литературным данным [20].
Известно, что конечные продукты гликирования, образующиеся при гипергликемии у больных СД, взаимодействуют с белками базальной мембраны, что приводит к изменению ее структуры, снижению эластичности сосудистой стенки, уменьшению ответа на действие NO [21]. В нашем исследовании выявлена отрицательная корреляционная зависимость между показателями НвА1с и ЭЗВД: r= -0,496, p=0,001.
Таблица 4. Корреляционная зависимость показателей СМАД и эндотелиальной функции
Показатель | ЭЗВД (Ad) | Эндотелин-1 | ||
r | p | r | P | |
Индекс времени САД (гипер) день | -0,40 | 0,068 | 0,33 | 0,041 |
Индекс времени САД (гипер) ночь | -0,49 | 0,047 | - | - |
Индекс времени САД (гипер) 24часа | -0,42 | 0,050 | - | - |
Суточный индекс САД | 0,44 | 0,043 | -0,39 | 0,031 |
Суточный индекс ДАД | - | - | -0,32 | 0,051 |
Рядом авторов отмечено, что при одинаковом уровне гликемии у пациентов с СД 1 и 2 типа нарушение функции эндотелия более выражено у больных СД 2 типа [21]. В нашем исследовании при сравнении показателей у пациентов с СД 1 типа ЭЗВД (Ad) составила 26,6±3,5%, у больных СД 2 типа почти в 2 раза меньше - 14,4±1,6%, (р<0,05), при этом больные СД1 и СД2 типа не отличались по возрасту и ИМТ. Различия уровня Э-1 при этом были недостоверны - 0,80±0,2 и 1,089±0,1 фмоль/мл соответственно (p>0,05). В ряде публикаций отмечается, что нормализация уровня гликемии может приводить практически к полному восстановлению эндотелиальной функции у пациентов с СД 1 типа, что не наблюдается у больных СД 2 типа. Следовательно, существуют и другие факторы, влияющие на формирование ДЭ при СД 2 типа. В частности, считается, что такими дополнительными факторами (помимо указанных выше гипергликемии и АГ) являются инсулиноре-зистентность (ИР) и дислипидемия.
В настоящее время ДЭ и ИР рассматриваются как тесно ассоциированные состояния. С одной стороны, утверждается, что ДЭ вторична по отношению к ИР и является следствием гиперинсулинемии, гипергликемии, дислипидемии и АГ. С другой стороны, считается, что ДЭ, в частности недостаточная ЭЗВД, способствует снижению транспорта инсулина через эндотелий и замедлению утилизации глюкозы тканями [21]. При анализе показателей ИРИ и НОМА-IR и ЭЗВД у больных СД 2 типа нами выявлена корреляционная зависимость: между ЭЗВД и ИРИ: r=-0,55, р=0,052; ЭЗВД и НОМА-IR: r=-0,44, р=0,034.
Известно, что в условиях дислипиде-мии под действием окисленных ЛПНП снижается активность эндотелиальной NO-синтазы и биодоступность NO. По данным других авторов высокий уровень ОХС вызывает повреждение эндотелия, при этом продукция NO сосудами увеличивается, а его биоактивность резко падает [22]. Е.П. Турмовой с соавт, показано, что длительная гиперлипидемия при гипотиреозе в эксперименте вызывает угнетение функции эндотелия и, возможно, способствует апопто-тической гибели эндотелиоцитов, приводит к снижению активности антиоксидантных систем [23]. В нашей работе выявлена корреляция уровня ОХС, ХС ЛПНП, ХС ЛПВП, ИА с величиной ЭЗВД. Зависимость Э-1 от параметров липидного спектра была недостоверной (табл. 5).
Наличие сопутствующего гипотиреоза оказывает отрицательное влияние на показатели ИР и липидного обмена у больных СД, особенно СД 2 типа [24], что подтверждается результатами данного исследования и было показано выше (табл. 2). Это может являться дополнительным механизмом ухудшения состояния эндотелия сосудов при коморбидной патологии - СД и первичный гипотиреоз.
Таблица 5. Корреляционная зависимость показателей липидного спектра и эндотелиальной функции
Показатель | ЭЗВД (Ad) | Эндотелин-1 | ||
r | p | r | p | |
ОХС | -0,45 | 0,046 | 0,23 | 0,086 |
Т риглицериды | - | - | - | - |
ХС ЛПНП | -0,37 | 0,052 | - | - |
ХС ЛПВП | 0,33 | 0,043 | - | - |
Индекс атерогенности | -0,49 | 0,031 | 0,34 | 0,055 |
В литературе описаны возможности медикаментозного воздействия на функцию эндотелия: предлагается использование антиоксидантов, статинов, фибратов, что требует дальнейшего изучения. Отмечено положительное влияние гликлазида МВ, метформина, инкретинов путем реализации основных и плейотропных эффектов (например, стимуляция экспрессии эндотелиальной NO-синтазы, влияние на нуклеарный фактор каппа ß - NFkB и др.), а также достижения целевых показателей углеводного, липидного обмена, АД, снижения инсулинорезистентности. Компенсация гипотиреоза при коморбидной патологии также может способствовать улучшению показателей функционального состояния эндотелия сосудов и профилактике микро- и макроваскулярных осложнений сахарного диабета.
Выводы
- Гипотиреоз, как манифестный, так и субклинический оказывает отрицательное влияние на показатели углеводного, липидного обмена, инсулинорезистентно-сти, артериальное давление у больных сахарным диабетом 1 и 2 типа.
- Особенностями артериальной гипертензии при сочетании сахарного диабета и первичного гипотиреоза являются увеличение индекса времени диастолического артериального давления и нарушение цир-кадности ритма артериального давления с преобладанием профиля нон-диппер.
- У больных коморбидной патологией- сахарный диабет и первичный гипотиреоз отмечаются более выраженные изменения функционального состояния эндотелия -снижение эндотелий-зависимой вазодилата-ции, свидетельствующее о нарушении сосудодвигательной функции эндотелия и более высокая концентрация показателя синтетической функции эндотелия - эндотелина-1. Параметры дисфункции эндотелия коррелируют с показателями углеводного, липидного обмена, инсулинорезистентности, уровнем тиреотропного гормона и артериального давления у больных сочетанной патологией.
- Достижение целевых уровней углеводного, липидного обмена, артериального давления, снижение инсулинорезистентно-сти, коррекция гипотиреоза способствует улучшению функционального состояния эндотелия при полиэндокринопатии - сахарный диабет и первичный гипотиреоз.
Конфликт интересов отсутствует.
References
- Дедов И.И., Шестакова М.В. Сахарный диабет. Острые и хронические осложнения. М.: МИА, 2011. 82 с.
- Дедов И.И., Шестакова М.В. Сахарный диабет типа 2: от теории к практике. М.: МИА, 2016. 75 с.
- Калинин Р.Е., Сучков И.А., Пшенников А.С., Новиков А.Н. Варианты экспериментального моделирования венозной эндотелиальной дисфункции: современное состояние проблемы // Российский медико-биологический вестник имени академика И.П. Павлова. 2014. №3. С. 143-147.
- Шишкин А.Н., Лындина М.Л. Эндотелиальная дисфункция, метаболический синдром и микроальбуминурия // Нефрология. 2009. №3. С. 24-32.
- Мартынюк Т.В., Чазова Н.Е. Новые возможности в стратегии лечения больных с идиопатической легочной гипертензией: антагонист рецепторов эндотелина бозентан // Системные гипертензии. 2008. №4. С. 3-6.
- Лебедева М.В., Стахова Т.Ю., Балкарев И.М., Минакова E.Г., Зайцева Л.И. и др. Альбуминурия, плазменная концентрация эндотелина-1 и атеросклеротическое поражение сонных артерий у больных артериальной гипертензией // Клиническая нефрология. 2009. №3. С. 57-61.
- Bensenor I.M., 0lmos R.D., Lotufo P.A. Hypothyroidism in elderly: diagnosis and management // Clin. Interv. Aging. 2012. Vol. 7. P. 97-111.
- Swamy R.M., Naveen K., Srinivasa K., Manjunath G.N., Byrav D.S., Venkatesh G. Evaluation of hypothyroidism as a complication in Type 2 Diabetes Mellitus // Biomedical Research. 2012. Vol. 23, № 2. P. 170-172.
- Дубинина И.И., Урясьев О.М., Карапыш Т.В. Оценка качества жизни и корреляция углеводного обмена, гормонального спектра у больных сахарным диабетом 2 типа с первичным гипотиреозом, осложненным дистальной нейропатией // Российский медикобиологический вестник имени академика И.П. Павлова. 2011. №4. С. 1-4.
- Петунина Н.А., Трухина Л.В., Мартиросян Н.С., Петунина В.В. Поражение различных органов и систем при гипотиреозе // Эффективная фармакотерапия. 2016. №4. С. 40-43.
- Селиванова Г.Б. Вопросы оптимизации лечения артериальной гипертензии при гипотиреозе: роль и место ингибиторов ангиотензин-превращающего фермента // Артериальная гипертензия. 2008. №3. С. 270-274.
- Lekakis J., Papamichael C., Alevizaki M. et al. Flow-mediated, endothelium-dependent vasodilatation is impaired in subjects with hypothyroidism, borderline hypothyroidism, and high-normal serum thyrotropin (TSH) values // Thyroid. 1997. Vol. 7, № 3. P. 411-414.
- Касаткина С.Г., Панова Т.Н. Влияние заместительной терапии субклинического гипотиреоза у больных сахарным диабетом 2-го типа на маркеры риска развития сердечно-сосудистых осложнений // Терапевтический архив. 2012. №11. С. 47-50.
- Xiang G., He Y., Zhao L. et al. Impairment of endothelium-dependent arterial dilatation in Hashimotos thyroiditis patients with euthyroidism // Clin. Endocrinol. 2006. Vol. 64, № 6. P. 698-702.
- Napoli R., Guardazole V. Acute effects of triiodthyronine on endothelial function in human subjects // J. Clin. Endocrinol. Me-tab. 2007. Vol. 92, № 1. P. 250-254.
- Maratou E., Hadjidakis D. J., Kollias A. et al. Studies of insulin resistance in patients with clinical and subclinical hypothyroidism // Eur. J. Endocrinol. 2009. Vol. 160, №5. P. 785-790.
- Трошина E.A., Александрова Г.Ф., Абдулхабирова E.M., Мазурина Н.В. Синдром гипотиреоза в практике интерниста. М., 2003. 39 с.
- Самитин В.В., Родионова Т.И. Факторы сердечно-сосудистого риска, связанные с функцией эндотелия, при субклиническом гипотиреозе // Клиническая и экспериментальная тиреоидология. 2009. №1. С. 26-29.
- Kalani M. The importance of endothelin-1 for microvascular dysfunction in diabetes // Vasc. Health Risk Manag. 2008. Vol. 4, № 5. P. 1061-1068.
- Кособян Е.П., Ярек-Мартынова Е.Р., Парфенов А.С., Болотская .Л., Шестакова М.В. Оценка состояния эндотелиальной функции и ригидности артериальной стенки у больных сахарным диабетом 1 типа на разных стадиях диабетической нефропатии // Сахарный диабет. 2011. №3. С. 55-59.
- Аметов А.С., Соловьева О.Л. Эндотелиальная дисфункция и пути ее коррекции. В кн.: Аметов А.С. Сахарный диабет 2 типа. Проблемы и решения. М.: ГЭОТАР-Медиа, 2013. С. 474-508.
- Загидуллин Н.Ш., Валеева К.Ф., Гасанов Н., Загидуллин Ш.З. Значение дисфункции эндотелия при сердечно-сосудистых заболеваниях и методы ее медикаментозной коррекции // Кардиология. 2010. №5. С. 54-60.
- Турмова Е.П., Лукьянов П.А., Григорюк А.А., Бычков Е.А., Цыбульский А.В. Развитие эндотелиальной дисфункции при экспериментальной гиперлипиде-мии // Тихоокеанский медицинский журнал. 2012. №1. С. 97-100.
- Берстнева С.В., Урясьев О.М., Дубинина И.И. Нарушения системы фибринолиза у больных сахарным диабетом в сочетании с гипотиреозом // Земский врач. 2015. №1. С. 49-53.
Supplementary files










