The role of hepcidin in the main iron-deficiency syndromes in pregnancy
- Issue: Vol 24, No 4 (2016)
- Pages: 96-103
- Section: Articles
- Submitted: 28.02.2017
- Published: 15.12.2016
- URL: https://journals.eco-vector.com/pavlovj/article/view/6074
- DOI: https://doi.org/10.23888/PAVLOVJ2016496-103
- ID: 6074
Cite item
Full Text
Abstract
Full Text
В настоящее время патогенез анемий беременных (АБ) рассматривается как мультифакторный [1]. Во время беременности возможно развитие сложных нарушений эритропоэза и обмена железа, что значительно затрудняет дифференциальную диагностику АБ и нередко является причиной резистентности к пероральной ферротерапии. Выделяют несколько железодефицитных синдромов (ЖДС): абсолютный дефицит железа, функциональный дефицит железа, синдром депонирования железа и группу наследственных ЖДС [2]. Верификация того или иного ЖДС позволяет выбрать наиболее рациональный вид терапии в каждом конкретном случае и минимизировать количество резистентных к терапии АБ. При абсолютном дефиците железа препаратами стартовой терапии являются препараты железа для перорального применения. Однако в ряде случаев, например, у беременных с H. pylori инфекцией, непереносимостью или резистентностью к перо-ральным препаратам железа, связанными с другими причинами, клиницист имеет право начать терапию железодефицитной анемии (ЖДА) с внутривенной ферротерапии. При тяжелой форме анемии, часто наблюдаемой у беременных, с доказанной неадекватно низкой продукцией эритро-поэтина (ЭПО) показана комбинированная терапия эритропоэзстимулирующими препаратами (ЭСП) и железом. В то же время в акушерской практике отсутствуют четкие критерии для выбора наиболее рациональной терапевтической опции при АБ. Любой лабораторный тест, способный стать таким критерием, мог бы значительно улучшить результаты лечения анемий беременных. Имеется сообщение, что повышенный уровень гепцидина (ГЦ) у пациента с анемией с высокой вероятностью прогнозирует резистентность к перораль-ной ферротерапии [3]. В настоящее время ГЦ считается основным регулятором обмена железа в организме человека и ключевым фактором развития анемии воспаления [4, 5]. Однако роль ГЦ при АБ недостаточно изучена.
Цель определить референсные значения ГЦ у беременных с нормальным течением беременности в различные триместры беременности и при различных анемиях беременных.
Материалы и методы
В 2011-2015 гг. нами были обследованы 78 беременных женщин с нормальным уровнем гемоглобина (Hb) в возрасте 16-45 (28,8±0,1) лет, состоящих на учете в женских консультациях г. Рязани и Рязанской области. Из них 9 (11,5%) в I, 25 (32,1%) во II и 44 (56,4%) в III триместрах беременности. У всех женщин определяли концентрацию ферритина сыворотки (ФС) и ГЦ. Контрольную группу составили 10 небеременных женщин с нормальным уровнем Hb.
Из 116 беременных с анемией, которые вошли в исследование, у 93 (80,2%) был установлен диагноз железодефицитной анемии (ЖДА) и у 23 (19,2%) - анемии смешанного генеза. Диагноз анемии верифицировали на основании результатов комплекса лабораторных тестов, включавших определение показателей обмена железа: сывороточное железо (СЖ), общая железосвязывающая способность сыворотки (ОЖСС) и уровень фер-ритина сыворотки (ФС). Критериями лабораторной диагностики для ЖДА у беременной являлись: Hb<110 г/л в 1 и 3 триместрах и значения Hb<105 во 2 триместре, ФС<20 мкг/л, НТЖ < 17%, ОЖСС>65 мкмоль/л [6-8]. Сыворотки беременных с анемией дополнительно обследовали на ЭПО и ГЦ.
Показатели гемограммы (30 параметров), включая уровень гемоглобина, количество ретикулоцитов, эритроцитов, тромбоцитов определяли на гематологическом анализаторе Sysmex 2000i (Япония). Уровень сывороточного ЭПО определяли методом твёрдофазного иммуно-ферментного анализа на микропланшет-ном фотометре STAT-FAX 3200 (США) с использованием наборов Biomerica (США). Уровень ГЦ определяли методом твёрдофазного иммуноферментного анализа на микропланшетном фотометре STAT-FAX 3200 (США) с использованием наборов Hepcidin-25 (Human, Peninsula Laboratories, LLS, США). Содержание СЖ и ОЖСС определяли на биохимическом анализаторе Accent 300 (Cormey, Польша) с использованием тест-систем фирмы Cormey. НТЖ рассчитывали по формуле СЖ/ОЖССХ100%. Уровень ФС определяли иммунохемилюминисцентным методом на анализаторе Access (Beckman Coulter, США) с использованием тест-систем фирмы Beckman Coulter (США).
Статистическая обработка результатов проводилась с использованием стандартных средств Microsoft Excel (критерий Стьюдента t, коэффициент корреляции r, уровень вероятности p). Для сравнения непараметрических показателей использовали критерий Манн-Уитни. Данные представлены как M±m (М - средняя величина показателя, m - ошибка средней). Статистически достоверным считали уровень значимости различий средних показателей при р<0,05.
Результаты и их обсуждение
Cредняя концентрация ГЦ в сыворотках крови беременных составила 26,4±8,78 мкг/л в I триместре беременности, 15,19±4,04 мкг/л во II триместре и 2,27±0,47 в III триместре (табл. 1).
Таблица 1. Средние значения концентрации гепцидинау беременных и __небеременных женщин_
Показатель | Беременные | |||
I триместр, n=9 | II триместр, n=25 | III триместр, n=44 | Всего, n=78 | |
Гепцидин, мкг/л | 26,4±8,78 | 15,19±4,04 | 2,27±0,47 | 9,2±1,89* |
* - p = 0,00000 | (по сравнению с небеременными женщинами) | |||
В общей группе из 78 беременных средняя концентрация ГЦ в сыворотках крови составила 9,2±1,89 мкг/л и была статистически достоверно ниже, чем средний уровень ГЦ в сыворотках крови у небеременных женщин - 27,4±2,69 мкг/л (p = 0,000001). В то же время, средний уровень ГЦ у беременных в I триместре составил 26,4±8,78 мкг/л и практически не отличался от среднего показателя сывороточного ГЦ у небеременных 27,4±2,69 мкг/л (p = 0,59). Статистический анализ показал средний уровень обратной корреляционной связи с r = -0,44 между сроком геста-ционного периода и концентрацией ГЦ в сыворотке крови беременной (рис. 1).
Средние показатели концентрации ферритина, ЭПО и ГЦ в сыворотках крови беременных с различными видами анемий представлены в таблице 2.
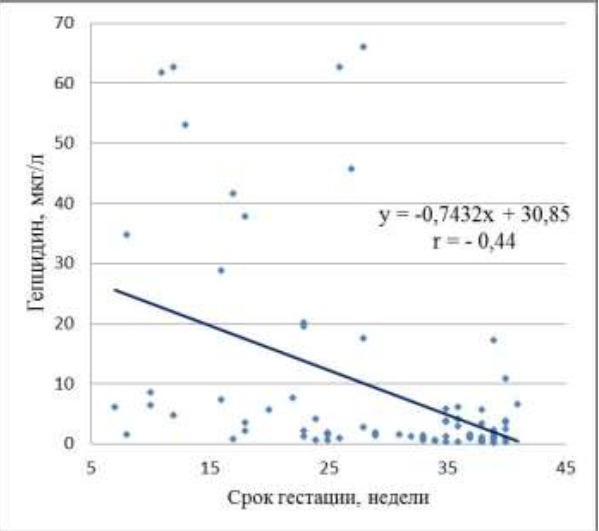
Рис. 1. Зависимость между концентрацией гепцидина в сыворотке крови и сроком гестационного периода у беременных (p = 0,00006)
Таблица 2. Средние показатели концентрации ЭПО и гепцидина в сыворотках крови беременных с различными видами анемий
Вид анемии беременных | Hb, г/л | ФС, мкг/л | ГЦ, мкг/л | ЭПО МЕ/л |
А 3 * Ь | 97,7±0,87 | 8,02±0,38 * | 3,5±1,12 ** | 53,78±3,98 *** |
Анемия смешанного генеза n=23 | 97,7±1,41 | 76,7±18,88 | 32,3±6,64 | 32,9±4,46 |
* - p = 0,00067 ** - p = 0,00007 *** - p = 0,00068
Средняя концентрация ГЦ в сыворотках крови беременных с ЖДА оказалась статистически достоверно ниже, чем у беременных с анемией смешанного генеза: 3,5±1,12 мкг/л против 32,3±6,64 мкг/л соответственно (p = 0,00007). Статистический анализ показал малую прямую корреляционную зависимость с r = 0,33 между концентрацией ГЦ и ФС в сыворотке крови беременных с анемией (рис. 2).
Средняя концентрация ЭПО в сыворотках крови беременных с ЖДА составила 53,78±3,98 МЕ/л и оказалась статистически достоверно выше, чем у беременных с анемией смешанного генеза -32,9±4,46 МЕ/мл (p = 0,00068). Проведенный статистический анализ показал слабую обратную корреляционную зависимость с r = -0,14 между концентрацией ГЦ и ЭПО в сыворотках крови беременных с анемиями (рис. 3).
Анемии у беременных представляют собой смешанную группу, представленную ЖДА, анемиями с нормальными показателями обмена железа, имеющими признаки анемии воспаления, но развивающиеся под влиянием патогенетических механизмов, по-видимому, связанных с самой беременностью (анемия беременных), анемией хронических болезней (АХБ) на фоне различных острых и/или хронических инфекционных заболеваний. Пероральная ферротерапия наиболее частый стартовый метод лечения

Рис. 2. Зависимость между концентрацией гепцидина и ферритина в сыворотках крови беременных с анемиями (p = 0,001)
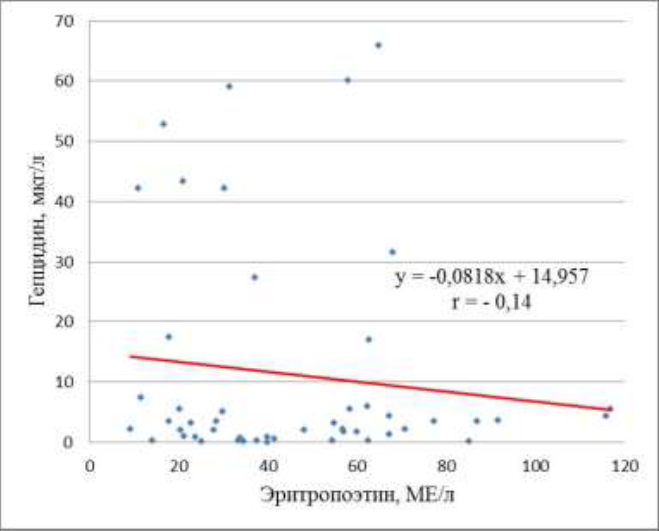
Рис. 3. Зависимость между концентрацией гепцидина и эритропоэтина в сыворотках крови беременных с анемиями (p = 0,18)
АБ. Однако пероральные препараты железа высокоэффективны только при абсолютном дефиците железа. В то же время при АБ часто встречаются и другие железодефицитные синдромы: функциональный дефицит железа и синдром депонирования железа, ассоциированный с анемией воспаления, вследствие чего может наблюдаться резистентность к пероральной ферротерапии. У беременных часто можно наблюдать анемии смешанного генеза, при которых наблюдается комбинация из двух или трех железодефицитных синдромов, что может потребовать замены пероральных препаратов железа на парентеральную ферротерапию или комбинированную терапию ЭСП в сочетании с препаратами железа. Поэтому дифференциальная диагностика анемий во время беременности и выбор лечебной тактики часто вызывает значительные трудности и имеет важное клиническое значение. В современном алгоритме дифференциальной диагностики анемий в акушерской практике отсутствуют четкие критерии для выбора наиболее рациональной терапевтической опции при АБ. ГЦ в настоящее время считается основным регулятором обмена железа и ключевым фактором развития анемии воспаления. Концентрация ГЦ существенно повышается в условиях воспаления, что приводит к снижению всасывания железа в кишечнике и реутилизации железа из клеток моноцитарно-макрофагальной системы. Именно по этой причине повышенная продукция ГЦ при анемиях воспаления и анемиях смешанного генеза может быть причиной неэффективности пероральных препаратов железа, что было показано в исследовании D.B. Bregman et al. (2013) [3]. Роль ГЦ в регуляции обмена железа у беременных изучена недостаточно. Согласно полученным нами данным средний уровень ГЦ у беременных оказался статистически достоверно ниже, чем у небеременных женщин (9,2±1,89 мкг/л против 27,4±2,69 мкг/л соответственно (p = 0,000001). При этом концентрация ГЦ в I триместре беременности не отличается от таковой у небеременных женщин, а в течение беременности с I по III триместр происходит статистически достоверное снижение продукции ГЦ с 26,4±8,78 мкг/л до 2,27±0,47 мкг/л соответственно. Об этом же свидетельствует выявленный нами средний уровень обратной корреляционной связи между сроком гестационного периода и концентрацией ГЦ в сыворотке крови беременной с r =-0,44 (рис. 1). Аналогичные данные были получены в ряде зарубежных исследований [9-13]. Отмеченная нами динамика ГЦ во время беременности в значительной степени объясняет снижение концентрации ферритина даже при физиологически протекающей беременности, а также повышение уровня кишечной абсорбции железа, начиная со второго триместра беременности, отмеченное S.R. Lynch (2000) [1, 14].
Концентрация ГЦ является одним важных маркеров анемии воспаления и критерием дифференциальной диагностики ЖДА и анемии хронических болезней в клинической практике [5]. В нашем исследовании средняя концентрация ГЦ в сыворотках крови беременных с ЖДА оказалась статистически достоверно ниже, чем у беременных с анемией смешанного генеза: 3,5±1,12 мкг/л против 32,3±6,64 мкг/л соответственно (p = 0,00007). Полученные данные свидетельствуют о том, что ГЦ принимает участие и в физиологической и в патологической регуляции обмена железа во время беременности.
В настоящее время установлена тесная взаимосвязь между ЭПО и ГЦ в регуляции эритропоэза. ЭПО стимулирует эритроид-ные клетки костного мозга, которые увеличивают продукцию эритоферона. Воздействуя на гепатоциты эритроферон снижает продукцию ГЦ и путем повышения кишечной абсорбции повышает доступность железа к эритроидным клеткам в костном мозге [15]. Однако ожидаемая обратная корреляция между уровнями ЭПО и ГЦ не подтвердилась при обследовании нами беременных с анемией. Обратная корреляционная зависимость между концентрацией ГЦ и ЭПО в сыворотках крови беременных с анемиями оказалась весьма слабой с r = - 0,14 (рис. 3). Однако этот факт лишний раз подтверждает мультифакторный патогенез АБ.
Заключение
Таким образом, полученные нами данные свидетельствуют о более высоком уровне гепцидина у беременных с анемиями смешанного генеза по сравнению с железодефицитными анемиями на фоне статистически достоверного снижения концентрации гепцидина при физиоло-гически протекающей беременности. Повышенный уровень гепцидина у беременной с анемией предположительно можно расценивать как прогностический фактор неэффективности пероральной ферротерапии. Необходимо установить концентрацию гепцидина при анемии беременных, которая будет основанием для стартовой терапии с парентеральных препаратов железа, а при сопутствующем низком уровне эритропоэтина в сочетании с эритропоэзстимулирующими препаратами.
Конфликт интересов отсутствует.
References
- Демихов В.Г. Анемии беременных: дифференциальная диагностика и патогенетическое обоснование терапии: автореф. дис. д-ра мед. наук. Рязань, 2003. 45 с.
- Демихов В.Г., Морщакова Е.Ф., Румянцев А.Г. Патогенез и лечение анемий беременных. Москва: Практическая медицина, 2015. 224 с.
- Bregman D.B., Morris D., Koch T.A., He A., Goodnough L.T. Hepcidin levels predict non-responsiveness to oral iron therapy in patients with iron deficiency anaemia // Am J Hematol. 2013. Vol. 88, №2. Р. 97-101.
- Park C.H., Valore E.V., Waring A.J., Ganz T. Hepcidin, a urinary antimicrobial peptide synthesized in the liver// J Biol Chem. 2001. Vol. 276: P. 7806-7810.
- Nemeth E., Valore E.V., Territo M., Schiller G., Lischtenstein A., Gantz T. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute phase protein// Blood. 2003. Vol. 101. P. 2461-2463.
- Centers of Disease Control (CDC). Criteria for Anemia in Children and Childbearing-Aged Women // Morbidity and Mortality Weekly Report. 1989. Vol. 38, № 22. P. 400-404.
- Шехтман М.М. Руководство по экстрагенитальной патологии у беременных. М., 1999. С. 373-392.
- Beaumont C., Beris Ph.., Brugnara C. Disorders of erythropoiesis, erythrocytes and iron metabolism // ESH. 2009. P. 135.
- Nicolas G., Bennoun M., Porteu A., Mativet S., Beaumont C., Grandchamp B. et al. Severe iron deficiency anemia in transgenic mice expressing liver hepcidin // Proc. Natl. Acad. Sci. USA. 2002. Vol. 99. Р. 4596-4601.
- Neves J.V., Olsson I.A., Porto G., Rodrigues P.N. Hemochromatosis and pregnancy: Iron stores in the Hfe-/- mouse are not reduced by multiple pregnancies // Am. J. Physiol. Gastrointest. Liver Physiol. 2010. Vol. 298. Р. G525-G529.
- Dao M.C., Sen S., Iyer C., Klebenov D., Meydani, S.N. Obesity during pregnancy and fetal iron status: Is hepcidin the link? // J. Perinatol. 2013. Vol.33. Р. 177-181.
- Van Santen S., Kroot J.J., Zijderveld G., Wiegerinck E.T., Spaanderman M.E.; Swinkels D.W. The iron regulatory hormone hepcidin is decreased in pregnancy: A prospective longitudinal study // Clin. Chem. Lab. Med. 2013. Vol. 51. Р. 1395-1401.
- Koenig M.D., Tussing-Humphreys L., Day J., Cadwell B., Nemeth E. Hepcidin and Iron Homeostasis during Pregnancy// Nutrients. 2014. №6. Р. 3062-3083.
- Lynch S.R. The Potential Impact of Iron Supplementation during Adolescence on Iron Status in Pregnancy // J. Nutr. 2000. Vol.130. P. 448S-451S.
- Kautz L., Jung G., Valore E.V., Rivella S., Nemeth E., Gantz T. Identification of erythroferrone as an erythroid regulator of iron metabolism // Nat Genet. 2014. Vol.46, № 7. Р. 678 - 684.
Supplementary files











