Опыт применения интраоперационного нейрофизиологического мониторирования при оперативных вмешательствах на позвоночнике
- Авторы: Кузьмина В.А.1, Сюндюков А.Р.1, Николаев Н.С.2,1, Михайлова И.В.2, Николаева А.В.1
-
Учреждения:
- ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России
- ФГБОУ ВО «ЧГУ им. И.Н. Ульянова»
- Выпуск: Том 4, № 4 (2016)
- Страницы: 33-40
- Раздел: Статьи
- Статья получена: 09.01.2017
- Статья одобрена: 09.01.2017
- Статья опубликована: 14.12.2016
- URL: https://journals.eco-vector.com/turner/article/view/5893
- DOI: https://doi.org/10.17816/PTORS4433-40
- ID: 5893
Цитировать
Аннотация
Цель исследования: провести анализ применения интраоперационного нейромоторинга (ИОНМ) при оперативных вмешательствах на позвоночнике в условиях ФГБУ «ФЦТОЭ» Минздрава России.
Материалы и методы. В ФГБУ «ФЦТОЭ» Минздрава России (г. Чебоксары) за период с 2009 по 2015 г. было проведено 366 операций на позвоночнике, требующих интраоперационного контроля функциональной целостности нервной системы пациента. Методом контроля за период 2009–2013 гг. служил wake-up-тест, который проводился у 116 (65,9 %) пациентов. Со второй половины 2013 г. под контролем ИОНМ было прооперировано 250 человек, при этом проведение wake-up-теста потребовалось у 9 (3,6 %) пациентов.
Результаты. Применение ИОНМ позволило вовремя выявить риски и сократить послеоперационные неврологические осложнения в 3 раза (с 2,6 до 0,8 %). Внедрение в практику ИОНМ дало возможность значительно расширить структуру оперированных пациентов за счет более сложной патологии. Количество операций при врожденной патологии увеличилось в 10 раз (с 1 до 10 %), дегенеративных заболеваний — в 2,6 раза. Появилась возможность контроля интраоперационных неврологических осложнений у больных с травмами позвоночника (5 %) и нейромышечным сколиозом.
Выводы и заключение. Применение ИОНМ позволило минимизировать количество wake-up-тестов, а также значительно сократить неврологические осложнения, вызванные повреждением спинного мозга и спинальных корешков в ходе манипуляций на позвоночнике.
Полный текст
Введение
В настоящее время хирургический способ широко применяется в лечении спинальной патологии и, безусловно, является основным в коррекции деформаций позвоночника [1]. Несмотря на совершенствование хирургической техники, сохраняются риски возникновения неврологических осложнений [2].
Внедрение в практику спинальных хирургов методик остеотомий позвоночника, систем с высоким потенциалом коррекции, позволяющих радикально устранить все составляющие деформации, малоинвазивных техник операций, манипуляций с дуральным мешком и корешками не снижает, а зачастую увеличивает риски возникновения ятрогенных неврологических осложнений [3, 4]. Так, частота неврологических осложнений, в зависимости от применяемого метода хирургического лечения, колеблется от 0,37 до 10 % [5]. Развитие подобных осложнений может быть обусловлено не только прямым механическим повреждением, растяжением или компрессией нервных структур, но и нарушением сосудистого питания спинного мозга, что связано с особенностями его кровоснабжения [6, 7]. Применение интраоперационного нейромониторирования (ИОНМ) дает возможность предотвратить подобные ситуации [8]. Кроме того, на современном этапе развития хирургической вертебрологии становятся актуальными малотравматичные методики хирургических вмешательств, в частности DLIF (XLIF), обязательным условием выполнения которых является применение ИОНМ [9, 10].
До внедрения в практику работы спинальных хирургов ИОНМ основным способом контроля неврологических осложнений был тест с пробуждением (так называемый wake-up-тест Stagnara), описанный в 1973 г. При проведении wake-up-теста анестезиолог прерывает действие анестетиков и мышечных релаксантов и пробуждает пациента до состояния, в котором тот может выполнять команды и пошевелить стопами. Если моторная функция не нарушена, анестезия и операция продолжаются. В противном случае немедленно решается вопрос об изменении хирургической тактики. Поскольку тест длится 15–20 минут, требует повторного введения анестетиков, применение более чем одного исследования в ходе вмешательства проблематично. Поэтому тест проводится после завершения основных корригирующих манипуляций, что значительно снижает его эффективность. При этом отсутствует возможность оценить функциональную целостность отдельных мышечных групп и нервных стволов. Использование wake-up-теста не позволяет в полной мере оценить неврологический статус [5]. Интраоперационное восстановление сознания может привести к развитию таких осложнений, как случайная экстубация и воздушная эмболия. Пациенты детского возраста не в состоянии выполнять команды анестезиолога во время пробуждения из-за затрудненного вербального контакта и ментального статуса [11].
При хирургических вмешательствах, в ходе которых могут быть затронуты нервные структуры, на сегодняшний день мировым стандартом контроля неврологических осложнений становится ИОНМ [12].
Оптимальной для ИОНМ является внутривенная анестезия с помощью гипнотика пропофола и анальгетика фентанила в сочетании с вдыханием кислородно-воздушной смеси и ингаляционных анестетиков, доза которых контролируется по максимальной альвеолярной концентрации (МАК). При необходимости использования миорелаксантов применяют препараты средней продолжительности действия. При проведении хирургических вмешательств под контролем ИОНМ для получения достоверных данных и исключения ложноотрицательных результатов исследования необходимо учитывать депрессорный эффект анестетиков на параметры вызванной активности. Механизмы влияния различны — от снижения корковой возбудимости, задержки аксонального проведения по кортикоспинальному тракту до снижения синаптической передачи на уровне спинальных альфа-мотонейронов [7, 13, 14].
Эффект общей анестезии и седации головного мозга оценивается с помощью биспектрального индекса (BiS), который рассчитывается на основе параметров непрерывно регистрируемой ЭЭГ. Данный индекс позволяет стабильно поддерживать глубину седации, уменьшает риск преждевременного выхода из наркоза, снижает расход анестетиков.
При оценке результатов ИОНМ у детей следует учитывать особенности созревания кортикоспинального тракта. Функциональные характеристики моторных путей начинают полностью соответствовать параметрам взрослого человека только в возрасте 12–14 лет. Причем миелинизация путей к мышцам нижних конечностей завершается раньше — в 11–12 лет, к мышцам верхних конечностей — в 12–17 лет. Окончательное созревание центрального отдела двигательного пути завершается только во втором десятилетии жизни [15, 16]. Особенностью пациентов детского возраста являются также небольшие размеры мышц, что требует точности при установке игольчатых электродов.
Цель исследования: провести анализ применения ИОНМ при оперативных вмешательствах на позвоночнике в условиях ФГБУ «ФЦТОЭ» Минздрава России (г. Чебоксары).
Материалы и методы
В ФГБУ «ФЦТОЭ» Минздрава России (г. Чебоксары), далее Центре, за период с 2009 по 2013 г. проведено 176 операций на позвоночнике, 116 (65,9 %) из них сопровождались риском развития неврологических осложнений и требовали интраоперационного контроля состояния нервной системы пациента. Методом контроля служил wake-up-тест. Первичная патология представлена сколиотической деформацией позвоночника III степени (51 %), на втором месте — сколиотическая деформация IV степени (32 %), в 10 % случаев встречались дегенеративные заболевания позвоночника, в 6 % — кифотическая деформация, лишь в 1 % случаев — врожденные пороки развития.
Со второй половины 2013 г. в практику работы центра введен ИОНМ, под контролем которого прооперировано 250 пациентов (70 мужчин и 180 женщин в возрасте от 2 лет до 71 года). Дети в возрасте до 7 лет составили 6,8 % (17 человек).
В структуре первичной патологии врожденные пороки развития позвоночника диагностированы у 10 %, дегенеративные заболевания — у 26 %, спинномозговая травма — у 5 %, сколиотическая деформация позвоночника III и IV степеней соответственно — у 22 и 33 %, кифозы — у 3 % пациентов.
Все пациенты, включенные в исследование, перед госпитализацией давали добровольное информированное согласие на проведение медицинских процедур, обследований, хирургических вмешательств, участие в научных исследованиях (Приказ № 125 от 30.12.2013 «О внедрении форм документов для правового обеспечения лечебно-диагностического процесса в ФГБУ "ФЦТОЭ"»).
ИОНМ выполнялся с применением системы NIM-Eclipse System фирмы Medtronic. Методика включала шесть тестов.
- Тест на миорелаксанты (TOF) использовался для измерения степени нервно-мышечной блокады (НМБ). Этот тест позволял исключить ложноотрицательные результаты, обусловленные эффектами паралитических средств. Мониторинг НМБ осуществлялся путем стимуляции соответствующего нерва и регистрации вызванного суммарного моторного потенциала в иннервируемой им мышце.
- Моторные вызванные потенциалы (МВП) регистрировались в соответствующих мышцах при транскраниальной электростимуляции двигательной коры головного мозга. Для получения МВП электроды устанавливали под кожу волосистой части головы по линии, отстоящей на ширину одного пальца вперед (по направлению к носу) от точек C3 и C4 и соответствующей проекции моторной зоны коры.
- Режим контроля приближения к нерву (N. Proxy) позволял контролировать корректное формирование канала для транспедикулярного винта. На инструмент хирурга фиксировалась петля, на которую подавался электрический стимул силой тока от 1 до 12 мА. При корректном проведении инструмента через дугу позвонка на мониторе прибора регистрировалась изолиния. По мере приближения проводника к невральным структурам появлялись ЭМГ-ответы нарастающей амплитуды на минимальную силу стимула. В таком случае хирург менял траекторию продвижения инструмента до исчезновения ЭМГ-ответа.
- Контроль правильности установки транспедикулярного винта во время фиксации позвоночника проводили с помощью пуговчатого зонда, на который подавался электрический стимул (режим Screw Integrity). О корректной установке винта строго в педикуле и отсутствии дефектов стенок транспедикулярного канала свидетельствовало отсутствие ЭМГ-ответа либо его появление на стимул высокой мощности. Наличие ЭМГ-ответа расценивали как близость к невральным структурам, обусловленную дефицитом костной ткани в педикуле. Чаще подобная ситуация отмечалась на вершине деформации по вогнутой стороне и объяснялась анатомо-морфологическими особенностями позвонков в этой зоне. При регистрации стойкого высокоамплитудного ЭМГ-ответа проводили контроль положения винта с помощью электронно-оптического преобразователя (ЭОП). При некорректном положении винта его убирали, если он не нес стратегическую нагрузку, или меняли траекторию проведения, в некоторых случаях транспедикулярный винт заменяли на другой фиксирующий элемент (крюк, лента).
- Исследование N. Root спинномозговых корешков с помощью автоматической электростимуляции. Интактные нервные корешки, обеспечивающие иннервацию мышц, формировали ЭМГ-ответ при мощности стимула менее 2 мА.
- ЭМГ-запись электромиограммы. Игольчатые электроды устанавливали в мышцы, соответствующие миотомам, иннервируемым определенными сегментами спинного мозга, на уровне хирургического вмешательства, перед обкладыванием пациента операционным бельем и созданием стерильного операционного поля.
В состав премедикации входили атропин, сибазон (реланиум) или дормикум, димедрол, которые вводились внутривенно за 5 минут до начала анестезии. Применялась общая и эндотрахеальная анестезия. Интубацию осуществляли оротрахеальным методом после внутривенного введения миорелаксанта суксаметония хлорида. После интубации больных переводили на ИВЛ. Для поддерживающей анестезии использовали фентанил, пропофол, севофлюран в МАК 0,3–0,5 %.
Хирургическая операция заключалась в следующем: осуществляли доступ к задним структурам позвоночника как открытым, так и малоинвазивным методом через системы специализированных ранорасширителей. Далее скелетировали задние костные структуры позвоночника и устанавливали опорные элементы металлоконструкции (транспедикулярные винты). В зависимости от целей оперативного вмешательства следующим этапом выполняли процедуру декомпрессии, остеотомии или корригирующего маневра. В дальнейшем стабилизировали достигнутый результат установкой спинальной системы. Завершали дорсальный этап хирургического вмешательства формированием спондилодеза вдоль металлоконструкции, рану послойно ушивали наглухо.
В зависимости от этапа хирургического вмешательства пациентам проводились: тест на миорелаксанты (TOF), тест приближения к нерву, screw-тест, ЭМГ. Кроме того, пациентам с дегенеративными заболеваниями позвоночника проводился тест N. Root. Для мониторирования состояния пирамидного тракта во время операций применялась транскраниальная стимуляция моторной коры (МВП).
Результаты и их обсуждение
Из 116 пациентов, прооперированных под контролем wake-up-теста, у 3 (2,6 %) при восстановлении сознания отсутствовали движения в ногах, что свидетельствовало о развитии интраоперационных неврологических осложнений. На фоне лечения у всех пациентов наблюдалось увеличение силы и чувствительности в ногах вплоть до полного восстановления.
Следует отметить, что с внедрением в практику работы Центра ИОНМ изменилась структура оперированных пациентов за счет более сложной патологии (рис. 1).
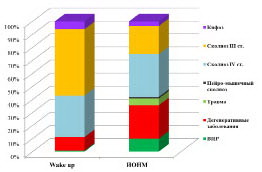
Так, со второй половины 2013 г. количество операций при врожденной патологии увеличилось в 10 раз (с 1 до 10 %), дегенеративных заболеваниях — в 2,6 раза. Появилась возможность контроля интраоперационных неврологических осложнений у больных с травмами позвоночника (5 %) и нейромышечным сколиозом. Количество больных, прооперированных по поводу кифоза позвоночника, сократилось с 6 до 3 %, при этом wake-up-тест проводился только у пациентов с болезнью Шейермана, а при ИОНМ превалировали кифозы с более сложной патологией (остеодисплазия, болезнь Бехтерева), требующие применения остеотомий 3–4-й групп по классификации Shwab, сопровождающихся высоким риском неврологических осложнений.
ИОНМ у всех 250 пациентов начинали с исследования МВП, в дальнейшем производилась динамическая оценка этого теста на протяжении всего оперативного вмешательства (табл. 1).
У большинства пациентов исходно и в ходе операции регистрировались нормальные значения МВП, что свидетельствовало о целостности двигательных путей и не требовало изменения хода операции. Отсутствие МВП исходно было зарегистрировано у 15 пациентов с синдромом оперированного позвоночника, последствиями спинномозговой травмы, кифосколиотической деформацией грудного отдела позвоночника IV степени и врожденной аномалией развития позвоночника с неврологическими нарушениями в виде парапарезов и плегии. В послеоперационном периоде неврологическая симптоматика сохранялась, что свидетельствовало о глубоком поражении двигательных путей. Усугубление неврологической симптоматики зафиксировано у 2 (0,8 %) пациентов, что было расценено как послеоперационное осложнение. В ходе последующего лечения наблюдалась положительная динамика (табл. 2).
Таблица 1. Результаты теста моторных вызванных потенциалов
Моторные вызванные потенциалы | Количество пациентов (в абс. числах) | Доля, % |
Норма | 204 | 81,6 |
Отсутствие | 15 | 6 |
Исходно нормальное значение моторных вызванных потенциалов со снижением амплитуды более чем на 70 % в ходе операции | 14 | 5,6 |
Моторные вызванные потенциалы у детей до 7 лет | 17 | 6,8 |
Итого | 250 | 100 |
Таблица 2. Сравнительная характеристика неврологических осложнений пациентов при проведении wake-up-теста и интраоперационного нейромониторирования
Пол | Возраст | Первичная патология | Величина деформации, угол по Cobb, ° | Неврологическое осложнение | Тест контроля |
м | 16 | Юношеский идиопатический сколиоз 4-й степени 3а-тип Lenke | 160 | Сосудистая миелопатия с нижним вялым парапарезом, нарушением болевой чувствительности по проводниковому типу с уровня D5 | Wake-up-тест |
м | 18 | Юношеский идиопатический сколиоз 4-й степени 3b-тип Lenke | 130 | Нижний вялый парапарез и нарушение болевой чувствительности по проводниковому типу с уровня D5 | Wake-up-тест |
м | 15 | Левосторонний нижнегрудной сколиоз 4-й степени на фоне остеохондродисплазии с верхнегрудной противодугой | 96 | Умеренно выраженный правосторонний вялый монопарез | Wake-up-тест |
м | 19 | Идиопатический инфантильный правосторонний грудной кифосколиоз 4-й степени, осложненный нижним спастическим парапарезом 2–3-й степеней, с сегментарными чувствительными нарушениями на фоне деформации позвоночника, миелопатии | 136 | Нижняя спастическая параплегия с тотальным нарушением поверхностной и глубокой чувствительности с уровня TH9-TH10 и тазовыми нарушениями по типу задержки мочи и стула | ИОНМ |
м | 3 | Врожденная аномалия развития позвоночника на фоне нарушения формирования, слияния позвонка Th12. Кифоз на уровне грудопоясничного перехода с дислокацией L1, стенозом позвоночного канала. Нейтральный порок развития шейного отдела. Нижний спастический парапарез средней степени с акцентом справа. Резидуальная энцефалопатия, задержка психоречевого развития | 69 | Нижняя вялая параплегия | ИОНМ |
У части пациентов (14 человек) при исходно нормальных значениях МВП в динамике наблюдалось снижение амплитуды моторных ответов более чем на 70 %, обусловленное преходящим нарушением проведения по двигательным путям, в связи с чем первоначальный план операции был изменен. Своевременное применение глюкокортикоидов, диуретиков, а также ослабление корригирующих воздействий у 5 пациентов привело к нормализации МВП и позволило продолжить оперативное вмешательство. Проведение wake-up-теста потребовалось у 9 (3,6 %) пациентов, во всех случаях он был положительным. Все пациенты данной группы имели выраженную деформацию позвоночника, требующую сложной хирургической коррекции. В послеоперационном периоде неврологические осложнения не зарегистрированы. Следует отметить, что до внедрения ИОНМ wake-up-тест проводился у 65,9 % больных.
Отдельную группу составили дети до 7 лет, оперированные по поводу пороков развития позвоночника и спинного мозга. При этом исходно регистрировались нормальные амплитуды МВП с прямой и косой мышц живота и сниженные, в некоторых случаях вплоть до изолинии, с мышц бедра и голени. Снижение амплитуды МВП связано с особенностью созревания кортикоспинального тракта и депрессорным влиянием на моторную кору ингаляционного анестетика севорана. Отмена севорана приводила к восстановлению МВП. Оптимальный интервал BiS для корректной оценки параметров ИОНМ составлял 33–50.
Учитывая способ проведения транспедикулярных опорных элементов хирургом по анатомическим ориентирам (hands-free-техника), важным тестом, применяемым при всех операциях, был тест N. Proxy — близости к невральным структурам. По результатам теста более чем у половины пациентов потребовалась коррекция действий хирурга.
Пациентам с дегенеративными заболеваниями позвоночника (34 человека), наряду с регистрацией МВП, применяли тест N. Root. Исходно и в конце операции у данных пациентов нормальные показатели МВП свидетельствовали о сохранности кортикоспинального пути. Тест N. Root позволил диагностировать глубину поражения спинномозговых корешков. Результаты теста коррелировали с клинической картиной: интактные корешки формировали ответ на стимул до 2 мА у 22 (64 %) пациентов, при парезе сила стимула увеличивалась до 6–10 мА у 8 (23,5 %) пациентов, при плегии ответ не регистрировался даже при максимальной силе стимула 15 мА у 4 (12,5 %) пациентов.
После установки транспедикулярных винтов проводили тест Screw Integrity. В нашей практике было 3 случая (1,2 %) получения ЭМГ-ответа при силе стимула 6 мА, что свидетельствовало об опасной близости винта к невральным структурам и потребовало проведения ЭОП. Подобная ситуация отмечалась на вершине деформации по вогнутой стороне и объяснялась анатомо-морфологическими особенностями позвонков в этой зоне. В одном случае при некорректном положении винта его убрали, так как он не нес стратегическую нагрузку, во втором — изменили траекторию проведения, в третьем случая транспедикулярный винт заменили на другой фиксирующий элемент (ленту).
Заключение и выводы
Успех оперативного вмешательства во многом зависит от согласованной работы всех участников операционной бригады: хирурга, анестезиолога, нейрофизиолога. Внедрение в практику ИОНМ позволило значительно расширить структуру оперированных пациентов за счет более сложной патологии. Так, увеличение процента использования ИОНМ у пациентов с дегенеративными заболеваниями позвоночника (в 2,6 раза) связано с возможностью контроля степени поражения нервных корешков. ИОНМ с использованием NIM-EclipseSystem позволяет в ходе операции многократно оценивать функциональную целостность двигательных проводящих путей и спинномозговых корешков от момента формирования канала для транспедикулярного винта до окончания оперативного вмешательства. При этом минимизируется количество wake-up-тестов, проведение которых более одного раза в ходе операции невозможно и небезопасно для пациента. Более того, выполнение сложных хирургических манипуляций (при врожденных пороках развития, тяжелых деформациях позвоночника, остеотомий III–IV типов) без ИОНМ невозможно.
Следует отметить, что проведение ИОНМ в детской практике требует индивидуального подхода. Необходимо учитывать небольшие размеры мышц и депрессорное влияние ингаляционных анестетиков.
Применение ИОНМ позволило вовремя выявить риски и сократить послеоперационные неврологические осложнения в 3 раза (с 2,6 до 0,8 %), расширить спектр выполняемых оперативных вмешательств, повысить качество лечения пациентов с патологией позвоночника.
Информация о вкладе каждого автора
В.А. Кузьмина — сбор и обработка материалов, анализ полученных данных, написание текста; А.Р. Сюндюков — сбор и обработка материалов, анализ полученных данных, написание текста, концепция и дизайн исследования; Н.С. Николаев — руководство, консультирование и дизайн исследования; И.В. Михайлова — консультирование, написание текста; А.В. Николаева — анализ полученных данных, написание текста; концепция и дизайн исследования.
Информация о финансировании и конфликте интересов
Работа проведена при поддержке ЧГУ им. И.Н. Ульянова. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Об авторах
Валентина Александровна Кузьмина
ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России
Автор, ответственный за переписку.
Email: doctorkuzmina@rambler.ru
врач функциональной диагностики Россия
Айрат Рашитович Сюндюков
ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России
Email: sndk-ar@yandex.ru
врач травматолог-ортопед детского травматолого-ортопедического отделения Россия
Николай Станиславович Николаев
ФГБОУ ВО «ЧГУ им. И.Н. Ульянова»; ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России
Email: fc1@orthoscheb.com
д-р мед. наук, заведующий кафедрой травматологии, ортопедии и экстремальной медицины Россия
Ирина Владимировна Михайлова
ФГБОУ ВО «ЧГУ им. И.Н. Ульянова»
Email: fake@eco-vector.ru
канд. мед. наук, доцент кафедры функциональной и лабораторной диагностики Россия
Алена Владиславовна Николаева
ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России
Email: orlova.alena@mail.ru
канд. мед. наук, врач-методист Россия
Список литературы
- Михайловский М.В., Фомичев Н.Г. Хирургия деформаций позвоночника. — Новосибирск, 2002. — 428 с. [Mikhailovskiy MV, Fomichev NG. Spinal Deformities Surgery. Novosibirsk; 2002. 428 p. (In Russ.)].
- Удалова И.Г., Михайловский М.В. Неврологические осложнения в хирургии сколиоза // Хирургия позвоночника. — 2013. — № 3. — С. 38–41. [Udalova IG, Mikhailovskiy MV. Neurological Complications in Scoliosis Surgery. Spine surgery. 2013;(3):38-41. (In Russ.)].
- Wright N. XLIF - the United States Experience 2003-4. International Meeting on Advanced Spinal Techniques Banff Alberta. Canada; 2005.
- Anenbach JD, Lenke LG, Bridwell KH, et al. Major complications & companison between 3-column osteotomy techniquses in 105 consecutive spinal deformity procedures. Spine. 2015;14:198-210.
- Новиков В.В., Новикова М.В., Цветовский С.Б., и др. Профилактика неврологических осложнений при хирургической коррекции грубых деформаций позвоночника // Хирургия позвоночника. — 2011. — № 3. — С. 66–74. [Novikov VV, Novikova MV, Tsvetkovskiy SB, et al. Prevention of Neurological Complications in Severe Spinal Deformities Surgery. Spine surgery. 2011;(3):66-74. (In Russ.)]
- Фоменко М.В., Голубев Г.Ш., Лака А.А., Купленский А.Э. Результаты хирургического лечения детей с прогрессирующим идиопатическим сколиозом // Хирургия позвоночника. — 2010. — № 2. — С. 35–40. [Fomenko MV, Golubev GSh, Laka AA, Kuplenskiy AE. Results of Surgical Treatment of Progressive Idiopathic Scoliosis in Children. Spine Surgery. 2010;(2):35-40. (In Russ.)].
- Хабиров Ф.А. Руководство по клинической неврологии позвоночника. — Казань: Медицина, 2006. — 518 с. [Khabirov FA. Guidelines for Clinical Neurology of Spine. Kazan: Medicine; 2006. 518 p. (In Russ.)]
- Щекутьев Г.А. Нейрофизиологические исследования в клинике НИИ нейрохирургии им. Н.Н. Бурденко. — М.: Антидор, 2001. — 233 с. [Schekutev GA. Neurophysiological Researches in Clinic Research Institute of Neurosurgery named after N.N. Burdenko. Moscow: Antidor; 2001. 233 p. (In Russ.)]
- Tohmeh AG, Rodgers WB, Peterson MD. Dynamically evoked, discrete-threshold electromyography in the extreme lateral interbody fusion approach. J Neurosurg Spine. 2011;14(1):31-37. doi: 10.3171/2010.9.spine09871.
- Wright N. XLIF-the United States Experience 2003-4. International Meeting on Advanced Spinal Techniques Banff Alberta. Canada, 2005.
- Хить М.А., Колесов С.В., Колбовский Д.А., Морозова Н.С. Роль интраоперационного нейрофизиологического мониторинга в предотвращении развития послеоперационных неврологических осложнений в хирургии сколиотической деформации позвоночника // Нервно-мышечные болезни. — 2014. — № 2. — С. 36–41. [Hit MA, Kolesov SV, Kolbovky DA, Morozova NS. The role of intraoperativeneurophysiological monitoring in prevention of postoperative neurological complications in scoliotic spinal deformation surgery. Neuromucular diseases. 2014;(2):36-41. (In Russ.)]
- Огурцова А.А. Интраоперационный нейромониторинг в нейрохирургии: сборник трудов. — М., 2013. — 74 с. [Ogurtsova AA. Intraoperative neuromonitoring in Nneurosurgery: Collection of Studies. Moscow; 2013. 74 p. (In Russ.)]
- Aatif M, Husain A. Practical Approach to Neurophysiologic Intraoperative Monitoring. New York; 2008. P. 882-898.
- The LAFS (Los Angeles Anesthesia Friendliness Scale). 2001.
- Никитин С.С., Куренков А.Л. Магнитная стимуляция в диагностике и лечении болезней нервной системы. Руководство для врачей. — М.: САШКО, 2003. — 378 с. [Nikitin SS, Kurenkov AL. Magnetic stimulation in the diagnosis and treatment of diseases of the nervous system. Guidelines for doctors. Moscow: Sashko; 2003. 378 р. (In Russ.)]
- Muller K, Kass-Iliyya F, Reitz M. Ontogeny of ipsilateral corticospinal projections: a developmental study with transcranial magnetic stimulation. Ann Neurol. 1997;42(5):705-711. doi: 10.1002/ana.410420506.
Дополнительные файлы









