Генно-инженерно-модифицированные организмы, разрешенные к выращиванию и разведению в России
- Авторы: Матвеева Т.В.1, Азарахш М.1
-
Учреждения:
- ФГБУ ВПО «Санкт-Петербургский государственный университет»
- Выпуск: Том 14, № 4 (2016)
- Страницы: 32-40
- Раздел: Статьи
- Статья получена: 03.02.2017
- Статья опубликована: 15.12.2016
- URL: https://journals.eco-vector.com/ecolgenet/article/view/5987
- DOI: https://doi.org/10.17816/ecogen14432-40
- ID: 5987
Цитировать
Полный текст
Аннотация
В июле 2016 года Государственной думой принят Федеральный закон «О внесении изменений в отдельные законодательные акты Российской Федерации в части совершенствования государственного регулирования в области генно-инженерной деятельности» (03.07.2016 № 358-ФЗ). Данный обзор посвящен анализу статьи 4 данного закона, а именно обсуждению того, какие генетически модифицированные организмы (ГМО) могут быть разрешены к выращиванию и разведению в России.
Ключевые слова
Полный текст
Введение
В июле 2016 г. Государственной думой принят Федеральный закон «О внесении изменений в отдельные законодательные акты Российской Федерации в части совершенствования государственного регулирования в области генно-инженерной деятельности» (03.07.2016 № 358-ФЗ) [1].
Статья 4 закона гласит «Пункт 1 статьи 50 Федерального закона от 10 января 2002 г. № 7-ФЗ „Об охране окружающей среды” (Собрание законодательства Российской Федерации, 2002, № 2, ст. 133; 2011, № 30, ст. 4596) дополнить абзацем следующего содержания:
„Запрещаются выращивание и разведение растений и животных, генетическая программа которых изменена с использованием методов генной инженерии и которые содержат генно-инженерный материал, внесение которого не может являться результатом природных (естественных) процессов, за исключением выращивания и разведения таких растений и животных при проведении экспертиз и научно-исследовательских работ“».
Рассмотрим в рамках данного обзора, какие генно-инженерные события могут протекать в естественных условиях и какие генетически модифицированные организмы (ГМО) аналогичны формам, которые могли бы возникнуть как результат естественных процессов. Иными словами, остановимся на тех примерах создания ГМО, которые не попадают под запреты, сформулированные в данном законе. Поскольку традиционно основные споры ведутся вокруг генетически модифицированных растений, мы ограничим ими круг обсуждаемых объектов.
Агробактериальная трансформация
Агробактериальная трансформация является на сегодняшний день наиболее распространенным методом получения трансгенных растений. В основе метода лежит способность агробактерий переносить фрагмент своей плазмиды (Ti или Ri), называемый Т-ДНК, и интегрировать его в хромосому растения-хозяина. В Т-ДНК закодированы гены, контролирующие пролиферацию клеток (онкогены), и гены синтеза опинов, необходимых для питания бактерий. В клетках растений гены Т-ДНК начинают экспрессироваться, вызывая развитие болезни: корончатый галл или косматый корень. Однако если заменить онкогены Т-ДНК целевыми генами, то из трансформированных тканей можно регенерировать целые трансгенные растения [2–4].
Некоторое время существовали опасения в отношении того, что растения-регенеранты наряду с привнесенными целевыми генами могут содержать участки Т-ДНК бактериального происхождения, что является неестественным. Данные сомнения были рассеяны после обнаружения в природе так называемых природно-трансгенных растений. Это виды, в геномах которых присутствуют фрагменты Т-ДНК агробактерий как результат горизонтального переноса генов. Природно-трансгенные виды описаны в пределах родов Nicotiana, Ipomoea, Linaria. Их предковые формы подверглись агробактериальной трансформации, были подхвачены отбором и дали начало новым видам, содержащим Т-ДНК в геномах [5–7]. То есть всю свою историю человек использует эти природно-трансгенные виды как лекарственные растения, а батат (Ipomoea batatas) еще и используется в пищу.
Таким образом, присутствие фрагментов Т-ДНК в геноме растения нельзя считать неестественным явлением. Значит, метод агробактериальной трансформации не попадает под запреты, сформулированные в обсуждаемом ФЗ.
Растения трансгенные, интрагенные и цисгенные
С 2006 г. в англоязычной научной литературе обсуждается возможность разделения генетически модифицированных организмов на группы в зависимости от источника трансгенов [8]. Более того, имеются указания на то, что данная идея была сформулирована еще раньше в книге «Терминология определяет моральную и политическую оценку современной биотехнологии», опубликованной в Нидерландах на голландском языке в 2000 г. [9].
В настоящее время организмы, в геном которых были введены гены организмов одного с ними вида или видов, с которыми они скрещиваются в естественных условиях, предложено называть цисгенными (в том случае, если введен ген с «собственными» регуляторными участками) либо интрагенными (если введен ген с регуляторными участками «чужих» генов). Под трансгенными организмами подразумевают организмы, в геном которых были при помощи методов генной инженерии введены отсутствующие там гены из филогенетически удаленных видов [8].
Исходя из данной формулировки, под запреты, сформулированные в обсуждаемом ФЗ, не попадают цисгенные растения, поскольку, хотя они и получены методами генной инженерии, содержат гены, которые могли бы быть получены растением в ходе отдаленной гибридизации.
К цисгенным растениям можно отнести также формы, в которые введены генно-инженерные конструкции, изменяющие экспрессию генов растения за счет запуска процесса РНК-интерференции.
РНК-интерференция (англ. RNA interference, RNAi) — процесс подавления экспрессии гена при помощи молекул малых РНК. Процесс РНК-интерференции начинается с образования молекул двухцепочечной РНК (дцРНК, англ. dsRNA). Далее фермент Dicer разрезает молекулы дцРНК на короткие фрагменты 19–25 нуклеотидов. Одна из двух цепочек каждого фрагмента является «направляющей» и затем включается в состав РНК-белкового комплекса RISC (англ. RNA-induced silencing complex — комплекс сайленсинга, индуцированного РНК). В результате активности RISC одноцепочечный фрагмент РНК соединяется с комплементарной последовательностью молекулы мРНК и вызывает разрезание мРНК белком Argonaute, являющимся каталитическим центром RISC. Кроме того, Argonaute является компонентом комплекса RITS (англ. RNA-induced transcriptional silencing — сайленсинг транскрипции, индуцированный РНК). Результатом RITS является химическая модификация гистонов, гетерохроматинизация соответствующих участков хромосом, подавление транскрипции соответствующих генов (рис. 1) [10–14].
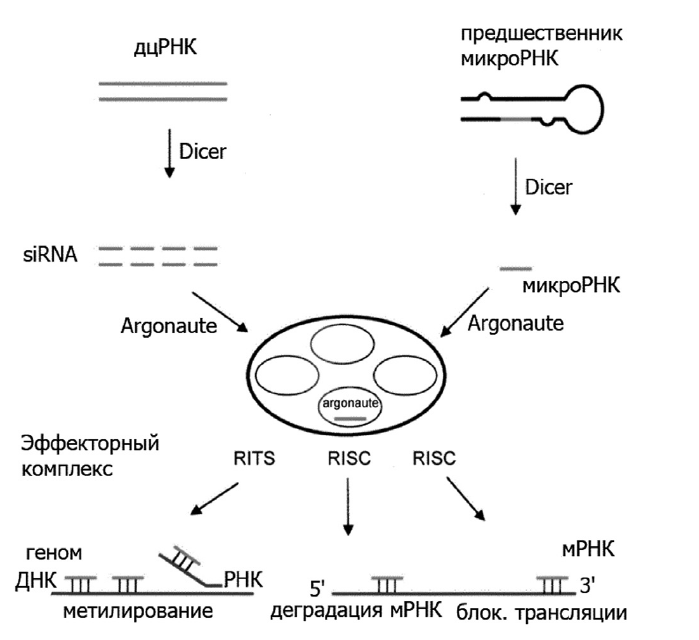
Рис. 1. Общая схема индукции сайленсинга
Fig. 1. The general scheme of silencing induction
За счет введения в растения генно-инженерных конструкций, индуцирующих сайленсинг генов, было получено множество линий трансгенных растений, разрешенных к коммерческому использованию. Сведения о некоторых таких линиях представлены в табл. 1 [15].
Таблица 1/ Некоторые примеры коммерческих линий генно-модифицированных растений, где использовано явление сайленсинга (по данным ISAAA) Some examples of commercial lines of genetically modified crops, where silencing effect have been used (based on ISAAA)
Вид | Линия | Конструкция | Эффект |
Томаты | 1345-4 | Модифицированный транскрипт гена синтазы-1-аминоциклопропан-1-карбоновой кислоты (ACC) | Cнижение синтеза этилена и замедление созревания плодов |
FLAVR SAVR™ B; Da и др. | Ген pg в антисмысловой ориентации | Подавлена транскрипция полигалактуроназы, что ведет к замедлению размягчения плодов | |
Huafan No 1 | Ген 1-аминоциклопропан-1-карбоксилат-оксидазы (ACO) в антисмысловой ориентации | Снижение экспрессии ACO, снижение синтеза этилена, замедление созревания | |
Соя | 260-05 (G94-1, G94-19, G168), DP305423 | Ген дельта-12-десатуразы в антисмысловой ориентации | Блокирует преобразование олеиновой кислоты в линолевую кислоту, приводя к накоплению мононенасыщенной олеиновой кислоты в семенах |
Картофель | AM04-1020 | Ген гранулосвязанной крахмал-синтазы (GBSS) в антисмысловой ориентации | Снижен уровень амилозы и повышен уровень амилопектина в крахмальных гранулах |
E12, E24, F10, F37 и др. | Образование двунитевой РНК гена asn1 | Деградация транскриптов ASN1, что приводит к снижению образования аспарагина | |
E12, E24, F10, F37 и др. | Образование двунитевой РНК гена pPhL | Деградация транскриптов PHL для ограничения образования сахаров за счет деградации крахмала | |
E12, E24, F10, F37 и др. | Образование двунитевой РНК гена ppo5 | Деградация транскриптов ppo5, что приводит к снижению потемнения тканей | |
Яблоня | GD743 | Образование двунитевой РНК гена PGAS PPO | Деградация транскриптов ppo, что приводит к снижению потемнения тканей |
Конструкции, индуцирующие сайленсинг, могут быть нескольких разновидностей. Они могут содержать последовательность целевого гена только в антисмысловой ориентации. Этот подход реализован при получении линии томатов FLAVR SAVR [16]. В другом варианте вектор для трансформации может кодировать последовательность с двумя комплементарными друг другу фрагментами целевого гена в смысловой и антисмысловой ориентации, разделенными спейсером. Такая последовательность в клетке будет приводить к синтезу РНК, образующей шпилечную структуру. Данный подход реализован в ходе получения линии GD743 яблони [17].
Отнесение линий с индуцированным сайленсингом к цисгенным или интрагенным будет зависеть от происхождения используемых промоторов и терминаторов. Кроме того, важным моментом является присутствие в Т-ДНК селективных маркеров. Линию можно считать цисгенной, если селективные маркеры получены из филогенетически близких по отношению к реципиенту видов или вовсе отсутствуют.
Рассмотрим в качестве примера линию W8 (торговая марка Innate™ Russet Burbank Potato) картофеля, полученную методом агробактериальной трансформации двумя плазмидами. В обоих типах плазмид в составе Т-ДНК не было селективных маркеров. Все последовательности из Т-ДНК для индукции сайленсинга плазмиды pSIM1278 получены из видов рода Solanum и находятся под контролем промоторов из S. tuberosum (табл. 2) [18].
Таблица 2. Основные структурные компоненты Т-ДНК плазмиды pSIM1278, использованной при получении линии W8 картофеля The main structural components of the T-DNA of the plasmid pSIM1278, used when receiving potato line W8
Номер | Структура | Вид — источник | Функция |
1 | Промотор гена АДФ глюкозопирофосфорилазы (pAgp) | S. tuberosum var. Ranger Russet | Тканеспецифичный промотор |
2 | Фрагмент гена аспарагин-синтазы-1 (asn1 в антисмысловой ориентации) | S. tuberosum var. Ranger Russet | Генерирует совместно с (6) дцРНК, которая является триггером деградации транскриптов asn1, снижая образование аспарагина (Chawla et al., 2012) |
3 | 3’-нетранслируемая последовательность гена полифенолоксидазы-5 (Ppo5 в антисмысловой ориентации) | S. verrucosum | Генерирует совместно с (5) дцРНК, которая является триггером деградации транскриптов Ppo5, снижая потемнение тканей |
4 | Спейсер-1 | S. tuberosum var. Ranger Russet | Последовательность между частями первого инвертированного повтора |
5 | 3’-нетранслируемая последовательность гена полифенолоксидазы-5 (Ppo5 в смысловой ориентации) | S. verrucosum | Генерирует совместно с (3) дцРНК, которая является триггером деградации транскриптов Ppo5, снижая потемнение тканей |
6 | Фрагмент гена аспарагин синтазы asn1 в смысловой ориентации | S. tuberosum var. Ranger Russet | Генерирует совместно с (2) дцРНК, которая является триггером деградации транскриптов asn1, снижая образование аспарагина (Chawla et al., 2012) |
7 | Промотор гена синтазы гранулосвязанного крахмала (конвергентная ориентация с pAgp) | S. tuberosum var. Ranger Russet | Один из двух конвергентных промоторов, активных преимущественно в клубнях, запускающих транскрипцию инвертированного повтора, содержащего фрагменты asn1 и Ppo5 |
8 | pAgp, вторая копия | S. tuberosum var. Ranger Russet | Один из двух конвергентных промоторов, активных преимущественно в клубнях, запускающих транскрипцию инвертированного повтора, содержащего фрагменты промоторов генов PhL и R1 |
9 | Фрагмент промотора гена фосфорилазы-L (pPhL) картофеля в антисмысловой ориентации | S. tuberosum var. Ranger Russet | Генерирует совместно с (13) дцРНК, которая является триггером деградации транскриптов PhL, снижая образование простых сахаров путем расщепления крахмала |
10 | Фрагмент промотора гена R1 (pR1) картофеля в антисмысловой ориентации | S. tuberosum var. Ranger Russet | Генерирует совместно с (12) дцРНК, которая является триггером деградации транскриптов R1, снижая образование простых сахаров путем расщепления крахмала |
11 | Спейсер-2 | S. tuberosum var. Ranger Russet | Последовательность между частями второго инвертированного повтора |
12 | Фрагмент промотора гена R1 (pR1) картофеля в смысловой ориентации | S. tuberosum var. Ranger Russet | Генерирует совместно с (12) дцРНК, которая является триггером деградации транскриптов R1, снижая образование простых сахаров путем расщепления крахмала |
13 | Фрагмент промотора гена фосфорилазы-L (pPhL) картофеля в смысловой ориентации | S. tuberosum var. Ranger Russet | Генерирует совместно с (9) дцРНК, которая является триггером деградации транскриптов PhL, снижая образование простых сахаров путем расщепления крахмала |
14 | Промотор pGbss в конвергентной ориентации по отношению ко второй копии pAgp | S. tuberosum var. Ranger Russet | Один из двух конвергентных промоторов, активных преимущественно в клубнях, запускающих транскрипцию инвертированного повтора, содержащего фрагменты промоторов генов PhL и R1 |
В Т-ДНК второй плазмиды pSIM1678 закодированы гены устойчивости к фитофторозу (табл. 3) [18].
Таблица 3. Основные структурные компоненты Т-ДНК плазмиды pSIM1678, использованной при получении линии W8 картофеля The main structural components of the T-DNA of the plasmid pSIM1678, used when receiving potato line W8
Номер | Структура | Вид — источник | Функция |
1 | Промотор гена фитофтороустойчивости (Rpi-vnt1) | S. venturii | Запускает экспрессию гена фитофтороустойчивости vnt1 |
2 | Ген фитофтороустойчивости (Rpi-vnt1) | S. venturii | Кодирует белок, отвечающий за устойчивость к фитофторе у Solanum venturii |
3 | Терминатор гена Rpi-vnt1 | S. venturii | Терминирует транскрипцию гена vnt1 |
4 | Промотор гена АДФ глюкозопирофосфорилазы (pAgp) | S. tuberosum var.Ranger Russet | Один из двух конвергентных промоторов, активных преимущественно в клубнях, запускающих транскрипцию инвертированного повтора, содержащего фрагменты гена кислой инвертазы |
5 | Фрагмент гена кислой инвертазы в смысловой ориентации | S. tuberosum var.Ranger Russet | Генерирует совместно с (6) дцРНК, являющуюся триггером деградации транскриптов гена инвертазы |
6 | Фрагмент гена кислой инвертазы в антисмысловой ориентации | S. tuberosum var.Ranger Russet | Генерирует совместно с (5) дцРНК, являющуюся триггером деградации транскриптов гена инвертазы |
7 | Промотор гена синтазы гранулосвязанного крахмала pGbss | S. tuberosum var.Ranger Russet | Один из двух конвергентных промоторов, активных преимущественно в клубнях, запускающих транскрипцию инвертированного повтора, содержащего фрагменты транскриптов гена инвертазы |
Помимо линии W8-аналогичные конструкции для придания фитофтороустойчивости, снижения акриламидного потенциала, степени потемнения клубней на срезе, повышения крахмалистости были применены при получении картофеля линий Х17 (торговая марка Ranger Russet Potato) и Y9 (торговая марка Atlantic Potato). А конструкция, описанная в табл. 2, использована для получения более десятка коммерческих линий, помимо указанных выше. Ни одна из этих линий не содержит генов устойчивости к антибиотикам или другим селективным маркерам. Все эти линии картофеля являются цисгенными.
На сегодняшний день известны цисгенные линии сои (Treus™, Plenish™) с измененным составом жирных кислот в семенах и устойчивостью к гербицидам на основе сульфонилмочевины, томатов (Huafan No 1) с замедленным созреванием, устойчивые к глифосату линии кукурузы (GA1 и ее производные) [19].
Все эти линии в соответствии с новым законом не попадают под ограничения открытого возделывания.
Редактирование генома
В последнее время все более популярными становятся методы редактирования геномов. Ранее в качестве методов для сайтспецифичного редактирования генома наиболее интенсивно применяли методы, основанные на использовании нуклеаз, содержащих цинковые пальцы (англ. Zinc-finger nucleases, ZFNs), а также эндонуклеазы TAL (англ. Transcription activator-like effector nuclease, TALEN). Эти методы довольно трудоемки, не очень эффективные и дорогостоящие [20, 21]. В последнее время наибольшее распространение получила система CRISPR-Cas [21].
Защитная система CRISPR-Casу бактерий
Защитная система CRISPR-Cas (CRISPR: англ. Clustered regularly interspaced short palindromic repeats, Cas: англ. CRISPR associated proteins) обладает способностью включать короткие последовательности из чужеродного генетического материала, так называемые спейсеры, в определенные места в пределах CRISPRs в геноме хозяина. Спейсеры транскрибируются и процессируются с образованием малых некодирующих РНК, которые в сочетании с конкретными белками Cas могут связываться с входящим чужеродным генетическим материалом, в случае если последовательность малой РНК и экзогенная нуклеиновая кислота соответствуют друг другу. Этот механизм обеспечивает приобретенный и наследственный иммунитет у хозяина. Однако некоторые очевидные различия между системой CRISPR-Cas и классической иммунной реакцией у позвоночных состоят в том, что в систему CRISPR-Cas могут быть легко встроены новые спейсеры (или, наоборот, убраны старые спейсеры), и такая активность позволяет этой системе динамично реагировать на вирус, у которого также высокие темпы изменчивости. Более того, спейсер-опосредованный иммунитет наследуется дочерними клетками, что согласуется с принципами эволюции Ламарка [22].
Защитный процесс CRISPR-Cas может быть разделен на три стадии (рис. 2) [22].
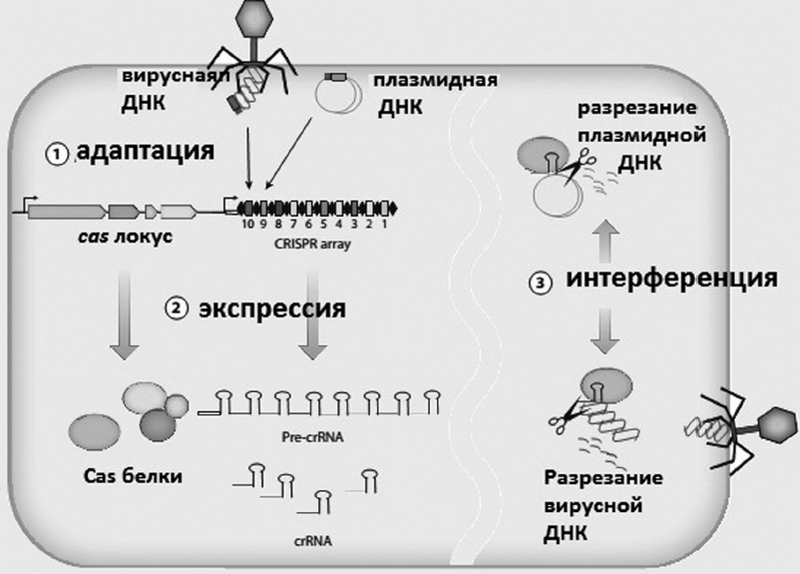
Рис. 2. Три стадии процесса CRISPR-Cas
Fig. 2. Three stages of CRISPR-Cas process
Первый этап — это так называемая адаптация [23, 24], или иммунизация [25], или приобретение спейсера [26]. Он включает в себя распознавание и последующую интеграцию спейсера между двумя соседними повторами в CRISPR-локусе. Спейсеры интегрируются в основном в одном конце (лидерный конец) локуса CRISPR.
В некоторых, но не во всех случаях существует очень короткая консервативная последовательность нуклеотидов в непосредственной близости протоспейсера. Она называется PAM (англ. protospacer adjacent motif) или CRISPR-мотив [27, 28], по-видимому, этот мотив необходим для встраивания фрагмента ДНК. На этом этапе требуется как минимум две нуклеазы — Cas1 и Cas2, которые являются универсальными, присутствующими у каждой CRISPR/Cas-системы.
На втором этапе происходит экспрессия CRISPR — образование первичного транскрипта, или pre-CRISPR RNA (pre-crRNA). Далее, специфичные эндорибонуклеазы расщепляют пре-crRNAs с образованием малых РНК CRISPR (crRNA).
На третьей и последней стадии, известной как интерференция [27], или собственно иммунитет [23], crRNA в составе мультибелковых комплексов могут распознавать комплементарную последовательность в чужеродной ДНК (или РНК). Это приводит к расщеплению комплексом crRNA чужеродной нуклеиновой кислоты. При этом если имеется несоответствие между спейсером и ДНК-мишенью или если существует мутация в PAM, то расщепление не инициируется. В этом случае ДНК не расщепляется, репликация вируса продолжается и хозяин не застрахован от вирусной атаки. Это приводит к лизису хозяина, и вирус освобождается и может атаковать другие восприимчивые клетки [22].
На основании филогении, последовательностей, организации и структуры локуса были выделены три типа системы CRISPR-Cas. Наиболее простой является система II типа. Именно ее и используют в генной инженерии. Остановимся подробнее на ее описании.
Отличительной чертой этой системы является белок Сas9 [23]. Cas9 содержит два нуклеазных домена: один на N-конце (RuvC) и второй домен (HNH) посередине аминокислотной последовательности Cas9. Для созревания Pre-crRNA необходима tracrRNA (англ. trans-encoded small RNA), которая связывается с crRNA и расщепляется с помощью РНКазы III хозяина. Белок Cas9 необходим на этапе созревания Pre-crRNA и также для последующего этапа интерференции. Зрелая crRNA вместе с Сas9 интерферируют с инвазивной ДНК.
Редактирования генома с использованием системы CRISPR-Cas типа II
Система CRISPR типа II из S. pyogenes была адаптирована для индукции двунитевых разрывов в последовательности ДНК и для целенаправленного редактирования генома [29]. В простейшей и наиболее распространенной форме этой системы, в клетки, для выполнения редактирования генома должны быть введены два компонента — нуклеаза Сas9 и гид-РНК (gRNA), состоящая из crRNA и tracrRNA. Двадцать нуклеотидов на 5’-конце гид-РНК (соответствующие последовательности протоспейсера в crRNA) направляют Сas9 к определенному участку ДНК-мишени. Сайты-мишени должны находиться непосредственно на 5’-последовательности PAM, которая соответствует канонической форме 5’-NGG (рис. 3).
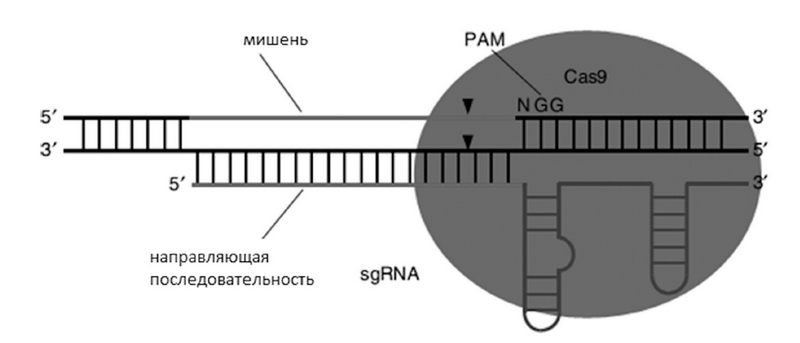
Рис. 3. Взаимодействие гид-РНК и сайта-мишени
Fig. 3. Interaction of the guide-RNA and the target site
С помощью этой системы нуклеаза Сas9 может быть направлена на любую последовательность ДНК в виде N20-NGG путем изменения первых 20 нуклеотидов в гид-РНК так, чтобы они соответствовали последовательности ДНК-мишени. Для редактирования генома также используется система CRISPR II типа из других видов бактерий, которые распознают альтернативные последовательности PAM и используют различные последовательности crRNA и tracrRNA [30, 31]. После того как в 2012 г. была показана возможность программирования белка Сas9 для разрезания различных участков ДНК в условиях in vitro [29], вышло множество статей, иллюстрирующих применимость системы для различных видов живых организмов. Первоначально было показано, что Сas9 может быть нацелена на редактирование генов бактерий [32], генов человека в культуре раковых клеток и плюрипотентных стволовых клеток [29]. Применительно к растениям модельные эксперименты по редактированию геномов были проведены на табаке [33, 34], арабидопсисе [33], рисе, пшенице, сорго [35, 36].
У арабидопсиса и N. benthamiana технологию CRISP-Cas применяли для повышения устойчивости растений к вирусной инфекции. Для этого были использованы разные последовательности гид-РНК, нацеленные на разные участки генома вируса BSCTV (beet severe curly top virus), и было показано, что все конструкции sgRNA-cas9 могли уменьшать накопление вируса. Устойчивость растений к вирусам была пропорциональна уровню экспрессии Cas9. У растений с наиболее высоким уровнем экспрессии Cas9 никаких очевидных симптомов заражения вирусом не наблюдали [37].
В другом исследовании система гид-РНК-Сas9 была использована для генерации наследуемого сайтспецифического мутагенеза у Arabidopsis thaliana. В этом эксперименте кодирующая область белка Сas9 была клонирована под промотором гена INCURVATA2 (ICU2), который кодирует одну субъединицу ДНК-полимеразы-альфа у Arabidopsis и обладает высокой активностью в пролиферирующих клетках, в том числе в меристемах. Этот факт позволяет надеяться, что мутации, возникшие в пролиферирующих тканях, под действием гид-РНК-Сas9 будут попадать в генеративные клетки и наследоваться [38].
Данная технология является достаточно молодой, поэтому пока известны только примеры ее успешного применения в фундаментальных исследованиях растений. Вместе с тем применительно к грибам были достигнуты определенные успехи и в прикладном направлении. Так, была получена разновидность шампиньона двуспорового Agaricus bisporus с мутированной копией одного из генов полифенолоксидазы. Эти грибы не темнеют на срезе. USDA отмечает, что данная линия не требует применения механизмов регулирования, относящихся к ГМО [39].
Эта и аналогичные ей формы живых организмов не попадают под ограничения, установленные российским законодательством после вступления в силу Федерального закона «О внесении изменений в отдельные законодательные акты Российской Федерации в части совершенствования государственного регулирования в области генно-инженерной деятельности» (03.07.2016 № 358-ФЗ).
Заключение
Методы генной инженерии открывают огромные возможности в плане получения новых перспективных линий живых организмов. Вместе с тем характер изменения генетического материала в разных линиях ГМО может быть различным. В данном обзоре мы обсудили подходы, которые позволяют получить ГМО с такими изменениями генома, которые могли бы произойти естественным путем в результате отдаленной гибридизации и мутационного процесса. Некоторые из обсуждаемых методов уже показали свою состоятельность, что нашло отражение в получении коммерческих линий ГМО, другие находятся на переходной стадии от фундаментальных к прикладным исследованиям.
Важно отметить, что на законодательном уровне в нашей стране к описанным формам растений будут применять более мягкие требования, чем к другим ГМО. Это согласуется с мировыми тенденциями.
Работа выполнена на средства гранта Президента РФ по поддержке ведущих научных школ НШ-9513.2016.4
Об авторах
Татьяна Валерьевна Матвеева
ФГБУ ВПО «Санкт-Петербургский государственный университет»
Автор, ответственный за переписку.
Email: radishlet@gmail.com
кафедра генетики и биотехнологии
РоссияМахбубе Азарахш
ФГБУ ВПО «Санкт-Петербургский государственный университет»
Email: mahboobeazarakhsh@gmail.com
кафедра генетики и биотехнологии
РоссияСписок литературы
- Федеральный закон «О внесении изменений в отдельные законодательные акты Российской Федерации в части совершенствования государственного регулирования в области генно-инженерной деятельности» (03.07.2016 № 358-ФЗ) [Federal Law “On Amendments to Certain Legislative Acts of the Russian Federation in terms of improving the state regulation in the field of genetic engineering” (03.07.2016 No 358-FL (In Russ.)]. http://www.consultant.ru/document/cons_doc_LAW_200732/
- Chilton MD, Drummond MH, Merio DJ, et al. Stable incorporation of plasmid DNA into higher plant cells: the molecular basis of crown gall tumorigenesis. Cell. 1977;11(2):26371. doi: 10.1016/0092-8674(77)90043-5.
- Chilton MD, Tepfer D, Petit A, et al. Agrobacterium rhizogenes insert T-DNA into the genome of the host plant root cells. Nature. 1982;295(5848):432-434. doi: 10.1038/295432a0.
- Burr T, Otten L. Crown gall of grape: biology and disease management. Annu Rev Phytopathol. 1999;37(1):53-80. doi: 10.1146/annurev.phyto.37.1.53.
- White FF, Garfinkel DJ, Huffman GA, et al Sequence homologous to Agrobacterium rhizogenes TDNA in the genomes of uninfected plants. Nature. 1983;301:348-350. doi: 10.1038/301348a0.
- Matveeva TV, Bogomaz DI, Pavlova OA, et al. Horizontal gene transfer from genus Agrobacterium to the plant Linaria in nature. Mol Plant Microbe Interact. 2012;25:15421551. doi: 10.1094/MPMI-07-12-0169-R.
- Kyndt T, Quispe D, Zhai H, et al. The genome of cultivated sweet potato contains Agrobacterium T-DNAs with expressed genes: An example of a naturally transgenic food crop. Proc Nat Acad Sci USA. 2015;112(18):5844-5849. doi: 10.1073/pnas.1419685112.
- Schouten H, Krens F, Jacobsen E. Do cisgenic plants warrant less stringent oversight? Nature Biotechnology. 2006;24(7):753. doi: 10.1038/nbt0706-753. PMID: 16841052.
- Jochemsen H. Toetsen en begrenzen: Een ethische en politieke beoordeling van de moderne biotechnologie. Buijten & Schipperheijn. 2000. 263 p.
- Matzke MA, Matzke AJM. Planting the seeds of a new paradigm. PLoS Biol. 2004;2(5):e133. doi: 10.1371/journal.pbio.0020133. PMID: 15138502.
- Bernstein E, Caudy A, Hammond S, Hannon G. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature. 2001;409(6818):363-6. doi: 10.1038/35053110. PMID: 11201747.
- Sun G. MicroRNAs and their diverse functions in plants. Plant Mol Biol. 2012Sep;80(1):17-36. doi: 10.1007/s11103-011-9817-6. Epub 2011 Aug 27.
- Holmquist G, Ashley T. Chromosome organization and chromatin modification: influence on genome function and evolution. Cytogenet Genome Res. 2006;114(2):96-125. doi: 10.1159/000093326. PMID: 16825762.
- Verdel A, Jia S, Gerber S, et al. RNAi-mediated targeting of heterochromatin by the RITS complex. Science. 2004;303(5658):672-6. doi: 10.1126/science.1093686. PMID: 14704433.
- Матвеева Т.В. Не совсем трансгенные растения // Вестник защиты растений. – 2016. – Т. 3. – № 89. – С. 106–108. [Matveeva TV. Not quite transgenic plants. Plant Protection Bulletin. 2016;3(89):106-108 (In Russ.)]
- Belinda M. First Fruit: The creation of the flavr savr tomato and the birth of biotech foods by McGraw-Hill companies. 2001. 269 p. ISBN10: 0071360565; ISBN13: 9780071360562.
- Carter N. Petition for Determination of Nonregulated Status: Arctic™ Apple (Malus x domestica) Events GD743 and GS784. United States Department of Agriculture — Animal and Plant Health Inspection Service. 2012. 163 p.
- Clark P, Habig J, Ye J, Collinge. Petition for Determination of Non-regulated Status for Innate Potatoes with Late Blight Resistance, Low Acrylamide Potential, Reduced Black Spot, and Lowered Reducing Sugars: Russet Burbank Event W8, United States Department of Agriculture — Animal and Plant Health Inspection Service. 2014. 199 p.
- https://www. isaaa.org. Дата последнего обращения 10.12.16.
- Власов В.В., Медведев С.П., Закиян С.М. «Редакторы» геномов. От цинковых пальцев до CRISPR // Наука из первых рук. – 2014. – Т. 56. – № 2. – С. 44–53. [Vlasov VV, Medvedev SP, Zakian SM Genomes “Editors”. From zinc finger to CRISPR. Science at first hand. 2014;56(2):44-53. (In Russ.)]
- Sontheimer EJ, Barrangou R. The bacterial origins of the CRISPR genome-editing revolution. Human Gene Therapy. 2015;26(7):413-424. doi: 10.1089/hum.2015.091. PMID: 26078042.
- Bhaya D, Davison M, Rodolphe B. CRISPR-Cas systems in bacteria and archaea: versatile small RNAs for adaptive defense and regulation. Annual Review of Genetics. 2011;45:273-297. doi: 10.1146/annurev-genet-110410-132430.
- Garneau JE, Dupuis ME, Villion M, et al. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 2010;468:67-71. doi: 10.1038/nature09523.
- Marraffini LA, Sontheimer EJ. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nature Review of Genetics. 2010;11:181-190.
- Horvath P, Barrangou R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 2010;327:167-170. doi: 10.1038/nrg2749.
- van der Oost J, Jore MM, Westra ER, et al. CRISPR-based adaptive and heritable immunity in prokaryotes. Trends in Biochemical Sciences. 2009;34:401-407.
- Deveau H, Garneau JE, Moineau S. CRISPR/Cas system and its role in phage-bacteria interactions. Annual Review of Microbiology. 2010;64:475-493.
- Mojica FJ, Diez-Villasensor C, Garcia-Martinez J, Soria E. Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements. J Mol Evol. 2005:174-82 doi: 10.1007/s00239-004-0046-3.
- Hou Zhonggang, Zhang Yan, Propson NE, et al. Efficient genome engineering in human pluripotent stem cells using Cas9 from Neisseria meningitidis. Proc Nat Acad Sci USA. 2013;110(39):15644-15649. doi: 10.1073/pnas.1313587110. PMID: 23940360.
- Gasiunas G, Barrangou R, Horvath P, Siksnys V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proceedings of the National Academy of Sciences of the United States of America. PNAS. 2012;109:E2579-2586. doi: 10.1073/pnas.1208507109.
- Jiang Wenyan, Maniv I, Arain F, et al. Dealing with the Evolutionary Downside of CRISPR Immunity: Bacteria and Beneficial Plasmids. PLoS Genetics. 2013;9(9): e1003844. doi: 10.1371/journal.pgen.1003844. PMID: 24086164.
- Jinek M, East A, Cheng A, et al. RNA-programmed genome editing in human cells. eLife. 2013;2:e00471. doi: 10.7554/eLife.00471.
- Li J, Norville JE, Aach J, et al. Multiplex and homologous recombination-mediated genome editing in Arabidopsis and Nicotiana benthamiana using guide RNA and Cas9. Nature Biotechnology. 2013;31:688-691. doi: 10.1038/nbt.2654.
- Nekrasov V, Staskawicz B, Weigel D, et al. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9-guided endonuclease. Nature Biotechnology. 2013;31:691-693. doi: 10.1038/nbt.2655.
- Shan Q, Wang Y, Li J, et al. Targeted genome modification of crop plants using a CRISPR-Cas system. Nature Biotechnology. 2013;31:686-688. doi: 10.1038/nbt.2650.
- Xie K, Yang Y. RNA-guided genome editing in plants using a CRISPR-Cas system. Molecular Plant. 2013;6:1975-1983. doi: 10.1093/mp/sst119.
- Ji X, Zhang H, Zhang Y, Wang Y, Gao C. Establishing a CRISPR-Cas-like immune system conferring DNA virus resistance in plants. Nat Plants. 2015;1:15144. doi: 10.1038/nplants.2015.144.Xie, K. & Yang, 2013.
- Hyun Y, Kim J, Cho SW, et al. Site-directed mutagenesis in Arabidopsis thaliana using dividing tissue-targeted RGEN of the CRISPR/Cas system to generate heritable null alleles. Planta. 2015Jan;241(1):271-84. doi: 10.1007/s00425-014-2180-5. Epub 2014 Oct 1.
- Waltz E. Gene-edited CRISPR mushroom escapes US regulation. A fungus engineered with the CRISPR-Cas9 technique can be cultivated and sold without further oversight. Nature. 2016;532:293.
Дополнительные файлы











